
科目: 来源: 题型:解答题
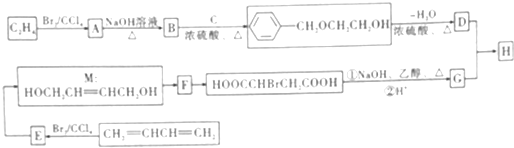
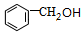 ,F中官能团的名称为羟基、溴原子
,F中官能团的名称为羟基、溴原子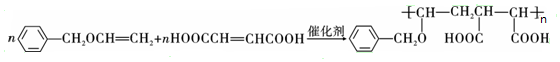
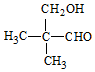 或
或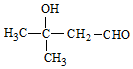 .
.查看答案和解析>>
科目: 来源: 题型:解答题
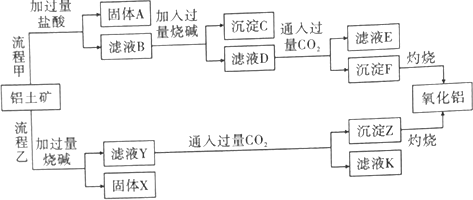
查看答案和解析>>
科目: 来源: 题型:实验题
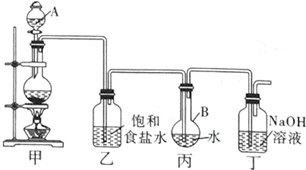
查看答案和解析>>
科目: 来源: 题型:选择题
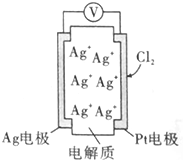 原电池的应用极为广泛.利用如下图所示原电池可测量空气中Cl2的含量,其中电解质是Ag+可以自由移动的固体物质,下列分析正确的是( )
原电池的应用极为广泛.利用如下图所示原电池可测量空气中Cl2的含量,其中电解质是Ag+可以自由移动的固体物质,下列分析正确的是( )| A. | 电流经外电路从Ag流向Pt电极 | |
| B. | 电池工作时,电解质中Ag+数目增多 | |
| C. | 正极反应:Cl2+2e-=2Cl- | |
| D. | 空气中c(Cl2)越大,Ag极消耗速率越快 |
查看答案和解析>>
科目: 来源: 题型:选择题
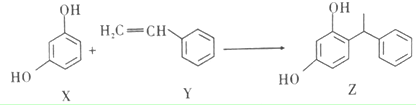
| A. | X、Y和Z均能和NaOH溶液反应 | |
| B. | X和Z均能和Na2CO3溶液反应,但不能和NaHCO3溶液反应 | |
| C. | Y既能发生加聚反应,也能发生缩聚反应 | |
| D. | Y分子中所有原子不可能共平面 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 使pH试纸变蓝色的溶液中:K+、Al3+、NO3-、SO42- | |
| B. | $\frac{{K}_{W}}{c({H}^{+})}$=1×10-12mol•L-1的溶液中:NH4+、Cu2+、Cl-、SO42- | |
| C. | 有较多Fe3+的溶液中:Na+、SCN-、K+、Na+、CO32- | |
| D. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、Cl- |
查看答案和解析>>
科目: 来源: 题型:实验题
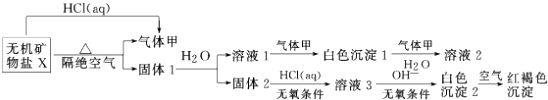
查看答案和解析>>
科目: 来源: 题型:填空题
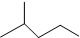 表示的分子式C6H14;名称2-甲基戊烷.
表示的分子式C6H14;名称2-甲基戊烷.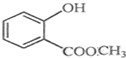 中含有的官能团的名称为酚羟基、酯基.
中含有的官能团的名称为酚羟基、酯基. .3-甲基-2-乙基-1-戊烯结构简式为CH3CH(CH3)CH2C(CH2CH3)=CH2.
.3-甲基-2-乙基-1-戊烯结构简式为CH3CH(CH3)CH2C(CH2CH3)=CH2.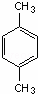 名称为对二甲苯.
名称为对二甲苯.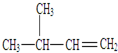 名称为3-甲基-1-丁烯.
名称为3-甲基-1-丁烯.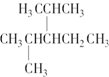 名称为2,4-二甲基-3--乙基戊烷.
名称为2,4-二甲基-3--乙基戊烷.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com