
科目: 来源: 题型:选择题
| A. | 只含一种分子的物质是纯净物,只含一种元素的物质也是纯净物 | |
| B. | 医疗上的血液透析利用了胶体的性质 | |
| C. | NH3溶于水后所得的溶液可以导电,所以NH3为电解质 | |
| D. | 从海水中可以得到NaCl,电解NaCl溶液可制备Na |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 外界条件不能改变平衡状态 | B. | 达平衡时正、逆反应速率相等 | ||
| C. | 各组分的含量不随时间而变化 | D. | 是动态平衡 |
查看答案和解析>>
科目: 来源: 题型:选择题
 如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池).下列有关说法不正确的是( )
如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池).下列有关说法不正确的是( )| A. | 放电时正极反应为:NiOOH+H2O+e-=Ni(OH)2+OH- | |
| B. | 电池的电解液可为KOH溶液 | |
| C. | 充电时负极反应为:MH+OH-=M+H2O+e- | |
| D. | MH是一类储氢材料,其氢密度越大,电池的能量密度越高 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②③④① | B. | ④②③① | C. | ④③①② | D. | ②①③④ |
查看答案和解析>>
科目: 来源: 题型:解答题

 ,该反应类型为取代反应.
,该反应类型为取代反应. .
.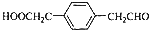 .
.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向100mL0.1mol•L-1的Na2CO3溶液中滴加含0.01molCH3COOH的醋酸溶液CO32-+CH3COOH═HCO3-+CH3COO- | |
| B. | 4mol•L-1的NaAlO2溶液和7mol•L-1的盐酸等体积均匀混合4AlO2-+7H++H2O═3Al(OH)3↓+Al3+ | |
| C. | 等物质的量的FeBr2与Cl2反应:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | 将少量SO2通入NaClO溶液中:SO2+ClO-+H2O═SO42-+Cl-+2H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com