
科目: 来源: 题型:选择题

| A. | 在外电路中,电子由银电极流向铜电极 | |
| B. | 取出盐桥后,电流计的指针仍发生偏转 | |
| C. | 外电路中每通过0.1 mol电子,铜的质量理论上减小6.4 g | |
| D. | 原电池的总反应式为Cu+2AgNO3=2Ag+Cu(NO3)2 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,8g甲烷中含C-H键的数目为4NA | |
| B. | 25℃时,1L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 1 mol冰醋酸和1mol乙醇经催化加热反应生成H2O的分子数为NA | |
| D. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.1NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2.24 L CH4气体中含有的电子数为NA | |
| B. | 25℃时,1.0 L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 0.1NA个氯气分子溶于水形成1 L溶液,所得溶液中c(Cl-)=0.1 mol/L | |
| D. | 1 mol CH3COONa和少量CH3COOH溶于水形成的中性溶液中,CH3COO-数目为NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 生成 SO3 为 2 mol | |
| B. | SO2 和 SO3 物质的量之和一定为 3 mol | |
| C. | 1molO2 恰好反应完 | |
| D. | SO2 的物质的量和 SO3 物质的量一定相等 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 发电厂的煤经脱硫处理 | |
| B. | 将煤汽化作燃料 | |
| C. | 回收并合理处理聚乙烯塑料废物 | |
| D. | 电镀废液(其中含重金属盐的离子)经中和后直接排放 |
查看答案和解析>>
科目: 来源: 题型:解答题
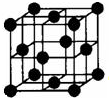 早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成.回答下列问题:
早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成.回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 5.6 g Fe与足量盐酸反应,反应中转移的电子数为0.3NA | |
| B. | 0.1 mol FeCl3完全水解转化为氢氧化铁胶体,生成0.1NA个胶粒 | |
| C. | 常温下,28 g的N2和CO混合气体含有的原子数为2NA | |
| D. | 1mol Na2O2和足量CO2充分反应,转移的电子数为2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 金属钠着火,可用泡沫灭火器扑灭 | |
| B. | 用10 mL量筒准确量取7.50 mL稀硫酸 | |
| C. | 用四氯化碳萃取溴水中的溴时,将溴的四氯化碳溶液从分液漏斗下口放出 | |
| D. | 在氢气还原氧化铜实验中,先加热氧化铜,后通入氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com