
科目: 来源: 题型:选择题
| A. | 都正确 | B. | 只有①② | C. | 只有①②③ | D. | 只有①②④ |
查看答案和解析>>
科目: 来源: 题型:推断题
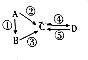
| 物质 | A | B | C | D |
| 元素种类 | 1 | 2 | 3 | 3 |
 ,物质C的化学式是HClO,写出反应A→D的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
,物质C的化学式是HClO,写出反应A→D的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 体积之比是2:3 | B. | 原子数之比是3:2 | ||
| C. | 质子数之别是1:1 | D. | 物质的量之比是1:1 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:推断题
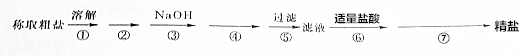
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向0.1mol•L-1氨水中加入少量水,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减少 | |
| B. | 将NH4Cl溶液从20℃升温至30℃,溶液中$\frac{c(N{H}_{4})}{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}$增大 | |
| C. | 向氢氧化钠溶液中加入醋酸至中性,溶液中$\frac{c(C{H}_{3}COO)}{c(N{a}^{+})}$=1 | |
| D. | 向含有BaSO4、BaCO3的饱和溶液中加入少量的Ba(NO3)2,溶液中的$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$减小 |
查看答案和解析>>
科目: 来源: 题型:解答题
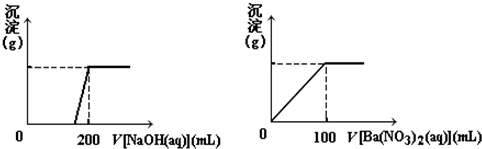
查看答案和解析>>
科目: 来源: 题型:选择题
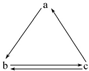 下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| 选项 | a | b | c |
| A | S | SO2 | SO3 |
| B | HNO3 | NO | NO2 |
| C | Si | SiO2 | H2SiO3 |
| D | NH3 | NO2 | NO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 配制一定物质的量浓度的溶液时,容量瓶必须洁净、干燥,不漏水 | |
| B. | 实验室里需要480 mL 2.0 mol/L的氢氧化钠溶液,配制该溶液时先称量氢氧化钠固体38.4 g,然后再按照溶解、冷却、移液、定容、摇匀的步骤进行操作 | |
| C. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液的浓度偏大 | |
| D. | 实验室配制500 mL 0.2 mol/L的硫酸亚铁溶液,其操作是用天平称量27.8 g绿矾,将其放入500 mL容量瓶,加水溶解、稀释、定容、摇匀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com