
科目: 来源: 题型:选择题
| A. | 用碳酸钠溶液吸收少量二氧化硫气体:2CO32-+SO2+H2O═2HCO3ˉ+SO32- | |
| B. | 金属铝溶于盐酸中 Al+2H+═Al3++H2↑ | |
| C. | 硫化钠溶于水 S2-+H2O═H2S↑+2OH- | |
| D. | 碳酸镁溶于硝酸中 CO32ˉ+2H+═H2O+CO2↑ |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 某化合物电离时,生成的阳离子有氢离子的一定是酸 | |
| B. | 某化合物电离时,生成的阴离子有氢氧根离子的一定是碱 | |
| C. | 某化合物电离时,只生成了金属阳离子和酸根离子的一定是盐 | |
| D. | NH4Cl是一种盐,电离的电离方程式是:NH4Cl=NH4++Cl- |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 标准状况下,22.4L水所含有的原子数目为3NA | |
| B. | 标准状况下,22.4 L H2中含质子数为2NA | |
| C. | 0.1mol•L-1稀硫酸100mL中含有硫酸根个数为0.1NA | |
| D. | 0.1molOH-含NA个电子 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题
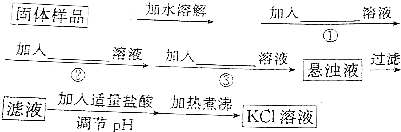
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 根据分散系的稳定性将其分为胶体、溶液和浊液 | |
| B. | 根据化合物在溶液中能否电离将其分为强电解质和弱电解质 | |
| C. | 根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸和多元酸 | |
| D. | 根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
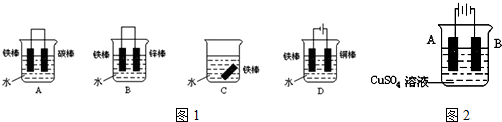
查看答案和解析>>
科目: 来源: 题型:解答题
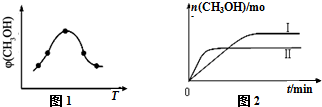
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验编号 | HA物质的量浓度(mol•L-1) | NaOH物质的量浓度(mol•L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com