
科目: 来源: 题型:选择题
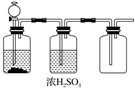
| A. | FeS和稀H2SO4 | B. | 加热NaCl和浓H2SO4制HCl | ||
| C. | 大理石和稀盐酸 | D. | MnO2和浓盐酸 |
查看答案和解析>>
科目: 来源: 题型:推断题
 由C与水反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑.
由C与水反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 所有的物质中都含有化学键 | |
| B. | 含有非极性键的化合物不一定是共价化合物 | |
| C. | 反应物总能量低于生成物总能量的反应一定是吸热反应 | |
| D. | 由非金属元素构成的化合物一定是共价化合物 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属质量/g | 9.0 | 4.8 | 0 | 0 |
| NO体积/L | 1.12 | 2.24 | 3.36 | V |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题
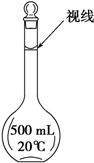 实验室配制500mL 0.2mol/L的FeSO4溶液,实验操作步骤有:
实验室配制500mL 0.2mol/L的FeSO4溶液,实验操作步骤有:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com