
科目: 来源: 题型:解答题
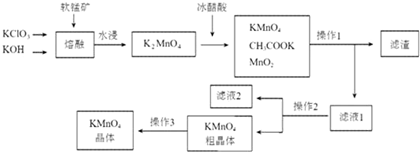
| 物质 温度 | KMnO4 | CH3COOK | K2SO4 | KCl |
| 20℃ | 6.34 | 217 | 11.1 | 34.2 |
| 90℃ | 45.2 | 398 | 22.9 | 53.9 |
查看答案和解析>>
科目: 来源: 题型:实验题
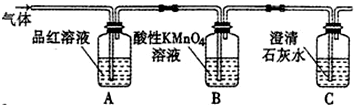
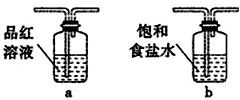
查看答案和解析>>
科目: 来源: 题型:解答题
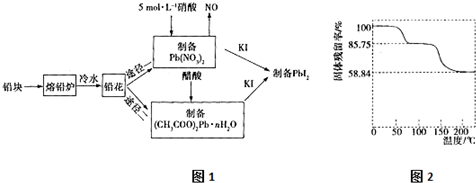
查看答案和解析>>
科目: 来源: 题型:解答题
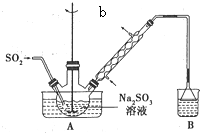 次硫酸氢钠甲醛(aNaHSO2•bHCHO•cH2O)俗称吊白块,有较强的还原性.它常温下比较稳定,在120℃以上分解成亚硝酸盐.以Na2SO3、SO2、HCHO和锌粉为原料可制备次硫酸氢钠甲醛.实验步骤如下:
次硫酸氢钠甲醛(aNaHSO2•bHCHO•cH2O)俗称吊白块,有较强的还原性.它常温下比较稳定,在120℃以上分解成亚硝酸盐.以Na2SO3、SO2、HCHO和锌粉为原料可制备次硫酸氢钠甲醛.实验步骤如下:查看答案和解析>>
科目: 来源: 题型:解答题
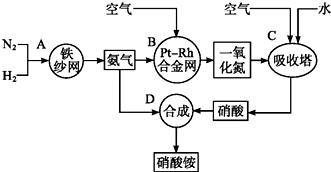
查看答案和解析>>
科目: 来源: 题型:解答题
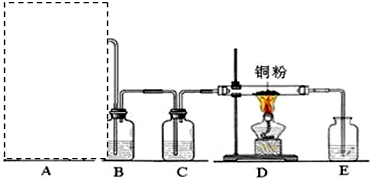
查看答案和解析>>
科目: 来源: 题型:解答题
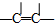 | ─C≡C─ | ─CH3 | ─CH2CH3 或─C2H5 | ─OH | ─CHO | ─COOH | -COO-R |

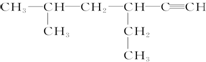
查看答案和解析>>
科目: 来源: 题型:选择题
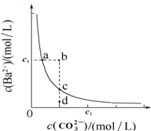
| A. | 通过蒸发可以使溶液由d点变到c点 | |
| B. | b点有BaCO3沉淀生成 | |
| C. | 升高温度,可以使d点变为c点 | |
| D. | 在a点加入Na2CO3,达平衡时c(Ba2+)≠c(CO32-),其Ksp大于c点对应的Ksp |
查看答案和解析>>
科目: 来源: 题型:解答题
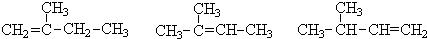
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com