
科目: 来源: 题型:实验题
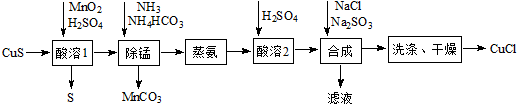
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  1,4-二甲基丁烷 | B. | 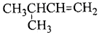 3-甲基丁烯 | C. | 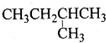 2-甲基丁烷 | D. | 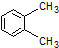 二甲苯 |
查看答案和解析>>
科目: 来源: 题型:填空题
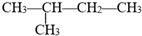 用系统命名法命名的名称是2-甲基丁烷,它的一氯代物有4种,若它是用烯烃和氢气加成而得到,则烯烃可能的结构简式是:CH2=(CH3)C-CH2-CH3;(CH3)2C=CH-CH3;(CH3)2CH-CH=CH2.
用系统命名法命名的名称是2-甲基丁烷,它的一氯代物有4种,若它是用烯烃和氢气加成而得到,则烯烃可能的结构简式是:CH2=(CH3)C-CH2-CH3;(CH3)2C=CH-CH3;(CH3)2CH-CH=CH2.查看答案和解析>>
科目: 来源: 题型:推断题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | F | Ne | |||
| 3 | Na | Al | P | S | Cl |
 ;
;查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:实验题
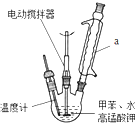 苯甲酸是一种化工原料,常用作制药和染料的中间体,也用于制取增塑剂和香料等.实验室合成苯甲酸的原理、有关数据及装置示意图如下:
苯甲酸是一种化工原料,常用作制药和染料的中间体,也用于制取增塑剂和香料等.实验室合成苯甲酸的原理、有关数据及装置示意图如下: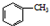 $→_{△}^{KMnO_{4}}$
$→_{△}^{KMnO_{4}}$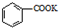 $\stackrel{HCl}{→}$
$\stackrel{HCl}{→}$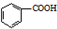
| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 密度(g/mL) | 溶解度(g) | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.4[1] | 248 | 1.2659 | 微溶[2] | 易溶 |

查看答案和解析>>
科目: 来源: 题型:解答题
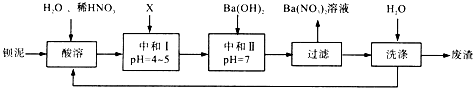
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com