
科目: 来源: 题型:实验题
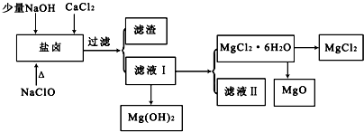
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
查看答案和解析>>
科目: 来源: 题型:解答题
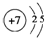 .
.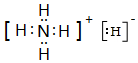 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 火力发电厂的煤经粉碎、脱硫处理 | B. | 电镀废液经中和后直接排入到农田 | ||
| C. | 聚乳酸塑料代替传统塑料作购物袋 | D. | 回收并合理处理聚氯乙烯塑料废物 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
 ①的气态氢化物的电子式
①的气态氢化物的电子式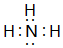 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 锗的第一电离能高于碳而电负性低于碳 | |
| B. | 乙烯分子中,只有一个碳碳π键,四个碳氢σ键 | |
| C. | 在铁制品上镀铜时,镀件为阳极,铜盐溶液为电镀液 | |
| D. | 甲醇分子内的O-C-H键角小于甲醛分子内O-C-H键角 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在一定条件下向容器中放入m molX和n mol Y,充分反应吸收Q kJ的能量 | |
| B. | 反应达到最大限度时,加入X,反应的△H增大 | |
| C. | 反应速率υ正(X)=$\frac{m}{n}$υ正(Y) | |
| D. | 降低温度,反应的速率值变大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将经过无害化处理的生活污水排放到漓江中 | |
| B. | 漓江沿岸不得开设造纸厂等污染企业 | |
| C. | 定期投放水生动物优化漓江生态 | |
| D. | 使用含磷洗涤剂且将洗涤后的废水排放到漓江中 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 微粒符号 | 质子数 | 中子数 | 电子数 | 质量数 |
| (1)K | ||||
| (2) | 18 | 20 | ||
| (3) | 16 | 18 | 32 |
 ,画出表中(3)的微粒结构示意图为
,画出表中(3)的微粒结构示意图为 .
.查看答案和解析>>
科目: 来源: 题型:实验题
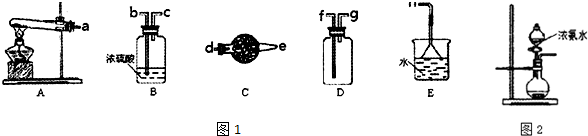
查看答案和解析>>
科目: 来源: 题型:实验题
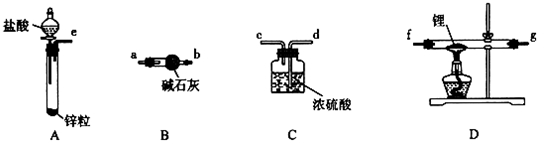
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com