
科目: 来源: 题型:解答题
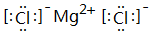 ,此化合物是(是、否)属于电解质,其溶于水所克服的微粒间作用力为离子键.
,此化合物是(是、否)属于电解质,其溶于水所克服的微粒间作用力为离子键.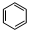 +HO-NO2$→_{50-60℃}^{浓硫酸}$
+HO-NO2$→_{50-60℃}^{浓硫酸}$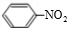 +H2O.
+H2O.查看答案和解析>>
科目: 来源: 题型:解答题
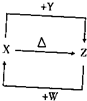
查看答案和解析>>
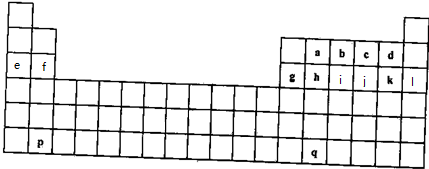
科目: 来源: 题型:推断题
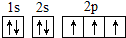 ,W的气态氢化物稳定性比H2O(g)弱(填“强”或“弱”).
,W的气态氢化物稳定性比H2O(g)弱(填“强”或“弱”).查看答案和解析>>
科目: 来源: 题型:解答题
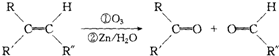
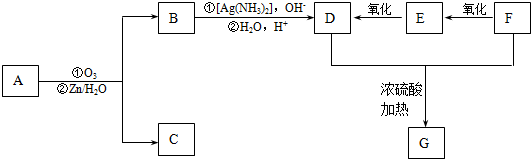
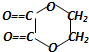 +2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.
+2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.查看答案和解析>>
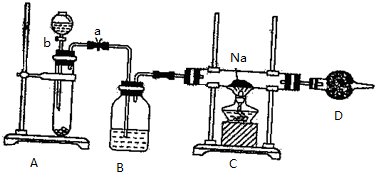
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 阿伏加德罗常数是12 g碳中所含的碳原子数 | |
| B. | 24 g镁的原子最外层电子数为NA | |
| C. | 阿伏加德罗常数约是6.02×1023 | |
| D. | 阿伏加德罗常数的符号为NA,近似为6.02×1023 mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 32gO2所含有的原子数目为NA | |
| B. | 0.5mol CO2含有的原子数目为1.5 NA | |
| C. | 1mol H2O含有的水分子数目为NA | |
| D. | 0.5NA个氧气分子的物质的量是0.5 mol |
查看答案和解析>>
科目: 来源: 题型:实验题
| 试剂 | 离子反应方程式 | |
| ①NaHCO3溶液(Na2CO3) | CO2 | CO2+H2O+CO32-=2HCO3- |
| ②Fe2O3(Al2O3) | NaOH溶液 | Al2O3+2OH-=2AlO2-+H2O |
| ③FeCl3溶液(FeCl2) | Cl2 | 2Fe2++Cl2=2Fe3++2Cl- |
| ④CO2(HCl) | 饱和的NaHCO3溶液 | HCO3-+H+=H2O+CO2↑ |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:推断题
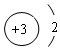 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com