
科目: 来源: 题型:多选题
| A. | 将Cl2通入NaOH溶液中:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 铜和稀硝酸的反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 钢铁吸氧腐蚀的正极反应:4OH--4e-═O2↑+2H2O | |
| D. | 将少量SO2通入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 钢铁发生电化腐蚀的正极反应式:Fe-2e-═Fe2+ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+ | |
| D. | 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑ |
查看答案和解析>>
科目: 来源: 题型:解答题
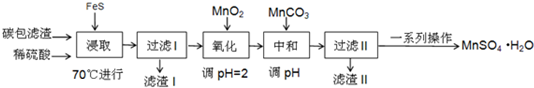
| 物质 | FeS | MnS | HgS |
| 溶度积 | 5×10-18 | 4.6×10-14 | 2×10-54 |
| Fe(OH)2 | Fe(OH)3 | Mn (OH)2 | |
| 开始沉淀时的PH | 6.3 | 2.7 | 8.3 |
| 沉淀完全时的PH | 8.4 | 3.7 | 9.8 |
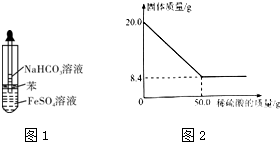
 .
.查看答案和解析>>
科目: 来源: 题型:实验题
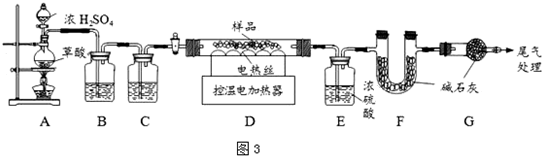
查看答案和解析>>
科目: 来源: 题型:选择题
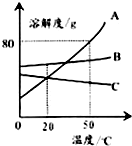
| A. | 50℃时A物质的溶解度最大 | |
| B. | 升温可使C物质的不饱和溶液变成饱和溶液 | |
| C. | 50℃时把90gA物质放入100g水中能得到190g溶液 | |
| D. | 将50℃三种物质的饱和溶液分别降温到20℃时,B溶液溶质质量分数最大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | A>C>B | B. | C>A>B | C. | C>B>A | D. | A>B>C |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 天然气能在氧气中燃烧,说明氧气具有可燃性 | |
| B. | 水通电分解时生成氢气和氧气,说明水是由氢气和氧气组成 | |
| C. | 将石蕊试液滴入稀硫酸中溶液显红色,说明石蕊试液能使酸变红 | |
| D. | 通过在显微镜下观察木炭,得知木炭具有疏松多孔的结构 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 所有自发进行的化学反应都是放热反应 | |
| B. | 熵值增大的反应都能自发进行 | |
| C. | 由能量判据和熵判据组合而成的复合判据,适合于所有的反应 | |
| D. | 同一物质的固、液、气三种状态的熵值相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com