
科目: 来源: 题型:选择题
| A. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| B. | 蒸馏操作时,应使温度计水银球插入蒸馏烧瓶内的液面以下 | |
| C. | 用蒸发的方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
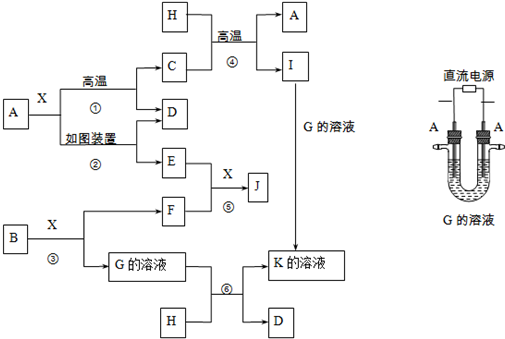
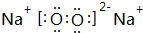 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| B. | 将Na2O2固体投入H218O中:2Na2O2+H218O═Na++4OH-+8O2↑ | |
| C. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液,恰好使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-═Al(OH)3↓+NH3•H2O+BaSO4↓ | |
| D. | 用石墨作两电极电解MgCl2溶液:2C1-+2H2O$\frac{\underline{\;电解\;}}{\;}$C12↑+2OH-+H2↑ |
查看答案和解析>>
科目: 来源: 题型:解答题
| 编号 | 电极材料 | 电解质溶液 | 电子流向 |
| ① | Mg-Al | HNO3(浓) | Mg→Al |
| ② | Mg-Al | HCl(aq) | Mg→Al |
| ③ | Mg-Al | NaOH(aq) | Al→Mg |
| ④ | Al-Cu | HNO3(浓) | Cu→Al |
查看答案和解析>>
科目: 来源: 题型:推断题
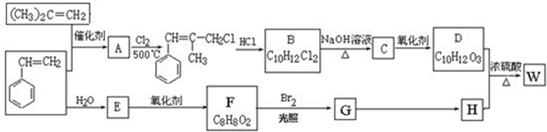

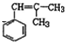 ;W的结构简式:
;W的结构简式: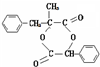 .
.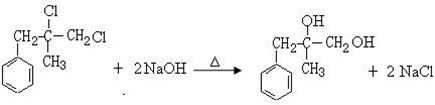 ;由D生成高分子化合物的方程式
;由D生成高分子化合物的方程式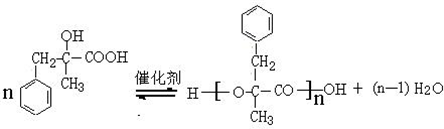 .
.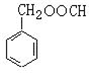 (写结构简式),其峰面积之比为1:2:2:2:1.
(写结构简式),其峰面积之比为1:2:2:2:1.查看答案和解析>>
科目: 来源: 题型:实验题
| 实验操作 | 实验现象 |
| ①取10ml一定溶质质量分数的硫酸铜溶液,倒入50ml的烧杯里 ②取一块钠,用滤纸吸干表面煤油,再切取绿豆大小的一块,投入溶液中 | 钠浮在液面上,熔化成闪亮小球,钠球游动,发出“嘶嘶”的声响,析出蓝色沉淀 |
| 实验操作 | 实验现象 | 结论 |
| 取烧杯中少许沉淀于试管中,再向其中加入过量的稀硫酸 | 沉淀全部溶解,溶液变蓝色 | 说明沉淀中不含红色的铜 |
查看答案和解析>>
科目: 来源: 题型:解答题
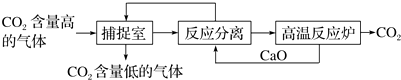
查看答案和解析>>
科目: 来源: 题型:实验题
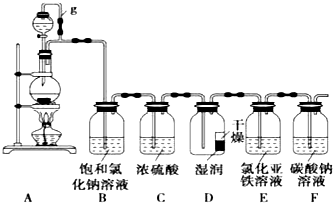 某探究小组为探究氯气的性质,并用装置F制取少量“漂白液”,设计了如下实验装置.请回答下列问题:
某探究小组为探究氯气的性质,并用装置F制取少量“漂白液”,设计了如下实验装置.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com