
科目: 来源: 题型:选择题
| A. | 金属钠投入水中,浮在水面熔成小球,并在水面快速移动,得到的溶液显碱性;Na+H2O═Na++OH-+H2↑ | |
| B. | 氢气在氯气中安静的燃烧,发出淡蓝色火焰,瓶口出现白雾;H2+Cl2═2HCl | |
| C. | 铜与稀硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO |
查看答案和解析>>
科目: 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡ | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
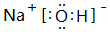 ,该物质和⑤的最高价氧化物对应水化物发生反应的化学反应方程式是NaOH+Al(OH)3=NaAlO2+2H2O
,该物质和⑤的最高价氧化物对应水化物发生反应的化学反应方程式是NaOH+Al(OH)3=NaAlO2+2H2O查看答案和解析>>
科目: 来源: 题型:推断题
| 元素 | T | X | Y | Z |
| 性质 结构 信息 | 人体内含量最多的元素,且其单质是常见的助燃剂. | 单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼 | 单质质软、银白色固体、导电性强.单质在空气中燃烧发出黄色的火焰. | 第三周期元素的简单离子中半径最小 |
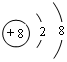 ;写出元素X的气态氢化物的电子式
;写出元素X的气态氢化物的电子式 ;写出Z元素原子的原子结构示意图:
;写出Z元素原子的原子结构示意图: ;元素Y的最高价氧化物对应水化物的电子式
;元素Y的最高价氧化物对应水化物的电子式
查看答案和解析>>
科目: 来源: 题型:实验题
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 除去乙醇中微量水用金属钠 | |
| B. | 溴苯中混有溴,加入水萃取 | |
| C. | 用酸性高锰酸钾除去乙烷中的乙烯 | |
| D. | 除去乙醇中少量的乙酸:加足量生石灰,蒸馏 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ②③④⑤⑥① | C. | ④⑤⑥②①③ | D. | ⑥④①②⑤③ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | “西气东输”中的“气”主要成分是甲烷 | |
| B. | 乙烯的结构简式为CH2CH2 | |
| C. | 分子式为C6H6的物质一定是苯 | |
| D. | 乙烯使溴水褪色说明乙烯与溴发生了取代反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 列 周期 | 1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 原子序数小于36的X、Y、Z、W四种元素,其中X形成的阳离子就是一个质子,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.回答下列问题:
原子序数小于36的X、Y、Z、W四种元素,其中X形成的阳离子就是一个质子,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com