
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
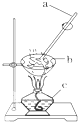 海水是盐的“故乡”,海水中含有各种盐类,其中70%为氯化钠,另外还含有氯化镁、硫酸镁等.
海水是盐的“故乡”,海水中含有各种盐类,其中70%为氯化钠,另外还含有氯化镁、硫酸镁等.
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢氟酸保存在用塑料盖的玻璃瓶中 | |
| B. | 稀硫酸可以用铁桶贮存 | |
| C. | 氯水盛放在棕色的玻璃瓶中 | |
| D. | 水玻璃保存在带有玻璃塞的玻璃瓶中 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑ | |
| B. | 铁粉加入三氯化铁溶液中:2Fe+Fe3+=3Fe2+ | |
| C. | AlCl3溶液中加入过量氨水:Al3++4OH-→AlO2-+2H2O | |
| D. | FeCl2溶液中加入氯水:Cl2+2 Fe2+=2 Fe3++2Cl- |
查看答案和解析>>
科目: 来源: 题型:推断题
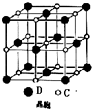 A、B、C、D 是原子序数依次增大的短周期主族元素,A 的基态原子中电 子占据三个能级,且各个能级的电子数相等;B 的一种氧化物为红棕色气体;C 的原子半径 是短周期中最大的.D 的电负性是同周期中最大的;E 是第四周期第VIII族三种元素中原子序数 最小的元素.用元素符号回答下列问题:
A、B、C、D 是原子序数依次增大的短周期主族元素,A 的基态原子中电 子占据三个能级,且各个能级的电子数相等;B 的一种氧化物为红棕色气体;C 的原子半径 是短周期中最大的.D 的电负性是同周期中最大的;E 是第四周期第VIII族三种元素中原子序数 最小的元素.用元素符号回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
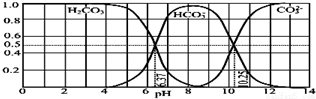
| A. | 此图是 1.0mol•L-1 碳酸钠溶液滴定 1.0mol•L-1 HCl 溶液的滴定曲线 | |
| B. | 在 pH 分别为 6.37 及 10.25 时,溶液中 c(H2CO3)=c(HCO3-)=c(CO32-) | |
| C. | 人体血液的 pH 约为 7.4,则CO2 在血液中多以 HCO3形式存在 | |
| D. | 若用CO2和NaOH反应制取Na2CO3易控制溶液的pH为7~9之间 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 推广碳捕集和储存技术,逐步实现 CO2的零排放 | |
| B. | 乙醇不能用于消毒杀菌 | |
| C. | 用 Na2S 除去工业废水中的 Cu2+离子 | |
| D. | 晶体硅可用于制造太阳能电池 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 第三周期第IA族 | B. | 第四周期第IA族 | C. | 第三周期第ⅡA族 | D. | 第四周期第ⅡA族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com