
科目: 来源: 题型:选择题
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | p1 | 12.0 | p2 | 24.0 |
| 平衡气体总浓度/10-3mol•L-1 | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
| A. | 混合气体的平均相对分子质量$\overline{M}$不再随时间变化的反应达到平衡状态 | |
| B. | 15.0℃时NH2COONH4(s)分解的平衡常数为2.0×10-9(mol/L)3 | |
| C. | 该反应△H>0,p2=2p1 | |
| D. | 若在恒温下将平衡体系体积减半,再达平衡后,c(NH3)和c(CO2)均比原平衡大 |
查看答案和解析>>
科目: 来源: 题型:解答题
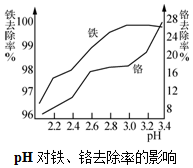 碱式硫酸铬可用于皮革、印染等行业.
碱式硫酸铬可用于皮革、印染等行业.查看答案和解析>>
科目: 来源: 题型:解答题

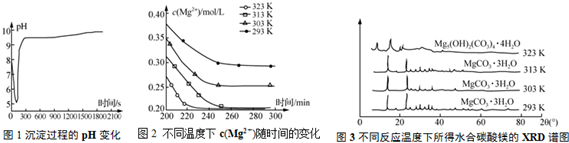
查看答案和解析>>
科目: 来源: 题型:解答题
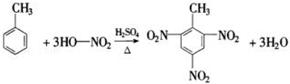 .
.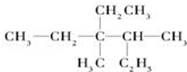 用系统命名法命名:3,4-二甲基-3-乙基己烷
用系统命名法命名:3,4-二甲基-3-乙基己烷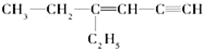 ,其中在同一平面上的碳原子至少为6个.
,其中在同一平面上的碳原子至少为6个.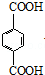 .
.查看答案和解析>>
科目: 来源: 题型:解答题



查看答案和解析>>
科目: 来源: 题型:解答题
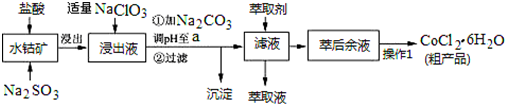
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
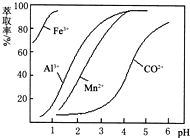
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 雪白、漂亮的“白木耳”,可能是在用硫黄熏制的过程中产生的SO2所致,食用对人体的肝、肾脏等有损害,并有致癌作用 | |
| B. | 可溶性硅酸盐与其他酸反应制得硅酸,生成的硅酸逐渐聚合而形成胶体溶液为硅胶,硅胶可用作食品干燥剂和催化剂载体 | |
| C. | 胶体化学的应用很广,是制备纳米材料的有效方法之一,某材料的直径在1~100nm之间,该材料均匀分散到某液体分散剂中,该分散系可产生丁达尔效应 | |
| D. | 在医疗上硫酸亚铁可用于生产防治缺铁性贫血的药剂,在工业上硫酸亚铁还是生产铁系列净水剂和颜料氧化铁红(主要成分为Fe2O3)的原料 |
查看答案和解析>>
科目: 来源: 题型:解答题
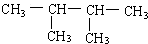 系统命名:2,3-二甲基丁烷
系统命名:2,3-二甲基丁烷
 的分子式:C4H8O
的分子式:C4H8O查看答案和解析>>
科目: 来源: 题型:解答题
 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷. 2-甲基丁烷.
2-甲基丁烷. 中含氧官能团的名称为羟基、羧基、酯基.
中含氧官能团的名称为羟基、羧基、酯基.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com