
科目: 来源: 题型:实验题
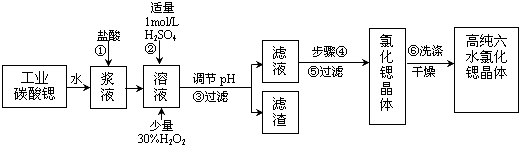
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
查看答案和解析>>
科目: 来源: 题型:实验题
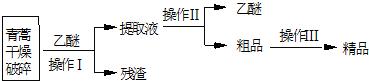
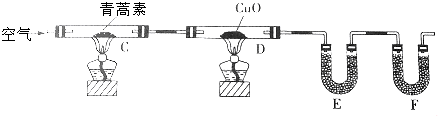
| 装置 | 实验前/g | 实验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
查看答案和解析>>
科目: 来源: 题型:实验题
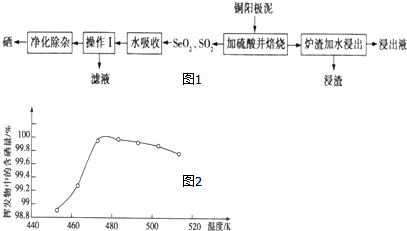
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | S(s)+O2(g)═SO2(g),反应放出的热量大于293.23 kJ•mol-1 | |
| B. | S(g)+O2(g)═SO2(g),反应放出的热量小于293.23 kJ•mol-1 | |
| C. | 1 mol SO2的键能总和大于1 mol硫和1 mol氧气的键能之和 | |
| D. | 1 mol SO2的键能总和小于1 mol硫和1 mol氧气的键能之和 |
查看答案和解析>>
科目: 来源: 题型:解答题
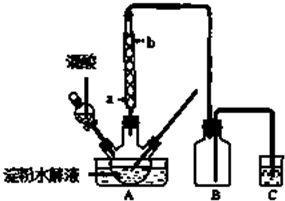
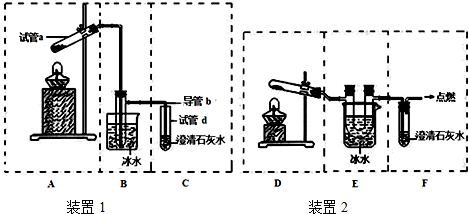
查看答案和解析>>
科目: 来源: 题型:解答题
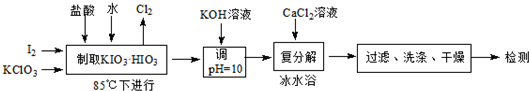
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
| KCl | 28.1 | 31.2 | 34.2 | 40.1 | 45.8 | 51.3 |
| Ca(IO3)2 | 0.119 | 0.195 | 0.3071 | 0.520 | 0.621 | 0.669 |
| 碘酸钙存在形态 | 无水盐 | 一水合物 | 六水合物 |
| 稳定时的温度区域 | >57.5℃ | 32-57.5℃ | <32℃ |
查看答案和解析>>
科目: 来源: 题型:解答题
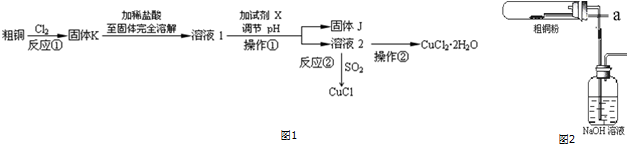
查看答案和解析>>
科目: 来源: 题型:实验题
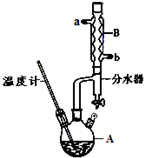 苯甲酸乙酯(C9H10O2)是一种无色透明液体,不溶于水,稍有水果香味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体,溶剂等.
苯甲酸乙酯(C9H10O2)是一种无色透明液体,不溶于水,稍有水果香味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体,溶剂等.
| 名称 | 相对分子质量 | 颜色,状态 | 沸点(℃) | 密度(g•cm-3) |
| 苯甲酸 | 122 | 无色片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 150 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 相同条件下,2mol H2完全燃烧时液态水放热572kJ | |
| B. | 相同条件下,2mol H2O完全分解吸收热量572kJ | |
| C. | 相同条件下,1mol H2充分燃烧生成气态水放热大于286kJ | |
| D. | 形成1mol H2O的化学键所释放的能量大于断裂lmol H2和0.5mol O2的化学键所吸收的总能量 |
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com