
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
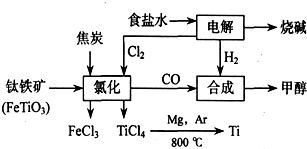
查看答案和解析>>
科目: 来源: 题型:实验题
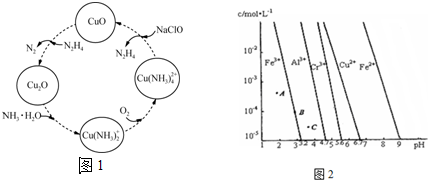
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:推断题
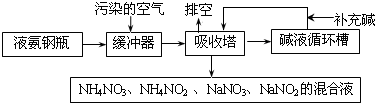
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol酸与1mol碱完全反应放出的热量就是中和热 | |
| B. | 如果反应在加热时才能发生,则该反应是吸热反应 | |
| C. | 反应物总能量大于生成物总能量,则反应的△H<0 | |
| D. | 强酸强碱中和热的离子方程式可表示为:H+(aq)+OH-(aq)═H2O(l)△H=57.3 kJ/mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 石墨不如金刚石稳定 | |
| B. | 金刚石不如石墨稳定 | |
| C. | 固体煤变成气体燃料后,燃烧效率变低 | |
| D. | 等质量的金刚石与石墨完全燃烧,石墨放出的能量多 |
查看答案和解析>>
科目: 来源: 题型:解答题
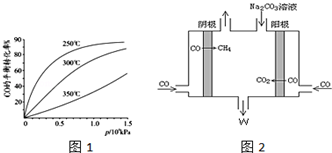
查看答案和解析>>
科目: 来源: 题型:实验题
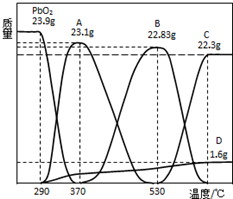 某种铅酸蓄电池具有廉价、长寿命、大容量的特点,它使用的电解质是可溶性的甲基磺酸铅,电池的工作原理:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l)
某种铅酸蓄电池具有廉价、长寿命、大容量的特点,它使用的电解质是可溶性的甲基磺酸铅,电池的工作原理:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l)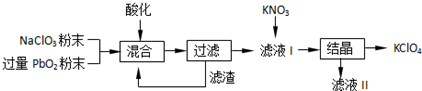
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com