
科目: 来源: 题型:
| 实验序号 | 实验内容 | 实验结果 |
| ① | 加足量NaOH溶液并加热 | 收集到气体2.24L(已折算成标准状况下的体积) |
| ② | 加足量BaC12溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后过滤、洗涤、干燥、称量 | 第一次称量读数为12.54g,第二次称量读数为4.66g |
| ||
| ||
| 阴离子符号 | 物质的量浓度(mol?L-1) |
SO42- SO42- |
0.1 0.1 |
CO32- CO32- |
0.2 0.2 |
无 无 |
无 无 |
查看答案和解析>>
科目: 来源: 题型:
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
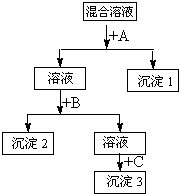 X、Y、Z三种可溶性盐,其阳离子分别Ba2+、Cu2+、Ag+中的某一种,阴离子分别是Cl-、SO42-、NO3-中的某一种.现做以下实验:
X、Y、Z三种可溶性盐,其阳离子分别Ba2+、Cu2+、Ag+中的某一种,阴离子分别是Cl-、SO42-、NO3-中的某一种.现做以下实验:| Ba2+ | Cu2+ | Ag+ | |
| Cl- | 溶 | 溶 | 不 |
| CO 32- | 不 | 不 | 不 |
| SO 42- | 不 | 溶 | 不 |
| S2- | 溶 | 不 | 不 |
查看答案和解析>>
科目: 来源: 题型:
| ||

查看答案和解析>>
科目: 来源: 题型:
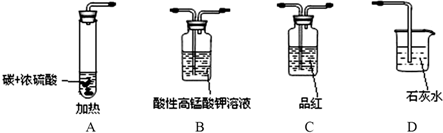
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
| 时间 | 开始 | 8h后 | 16h后 | 24h后 | 32h后 | 40h后 | 48h后 |
| pH | 5.0 | 4.8 | 4.6 | 4.3 | 4.2 | 4.0 | 4.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com