
科目: 来源: 题型:解答题
| H2和Cl2的物质的量关系 | n(H2)=n(Cl2) | n(H2)>n(Cl2) | n(H2)<n(Cl2) |
| 生成NaCl的物质的量 | amol(或bmol) | bmol | amol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硝酸钾 | B. | 醋酸钠 | C. | 硫酸氢钠 | D. | 硫酸铜 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 共价键 | 断开该键吸收的能量或生成该键放出的能量/kJ•mol-1 | 共价键 | 断开该键吸收的能量或生成该键放出的能量/kJ•mol-1 | 共价键 | 断开该键吸收的能量或生成该键放出的能量/kJ•mol-1 |
| H-H | 436 | H-Br | 366 | Cl-Cl | 243 |
| H-O | 463 | H-I | 298 | Br-Br | 193 |
| H-Cl | 432 | O=O | 496 | I-I | 151 |
| A. | ①④ | B. | ②③ | C. | 只有① | D. | 只有④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,18gH218O所含质子数为10NA | |
| B. | 1 mol乙醇中含有极性键的数目为8NA | |
| C. | 1mol的-NH2与1molNH4+所含电子数均为10NA | |
| D. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
查看答案和解析>>
科目: 来源: 题型:解答题
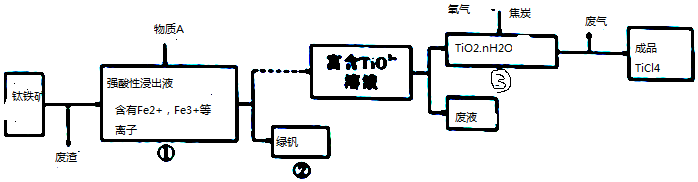
| Mg | MgCl2 | Ti | |
| 熔点/℃ | 648.0 | 714 | 1667 |
| 沸点/℃ | 1090 | 1412 | 3287 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
| 键能 | 键能 | 键能 | |||||
| H-H | 436 | Cl-Cl | 243 | H-Cl | 432 | ||
| S-S | 255 | H-S | 339 | C-F | 427 | ||
| C-Cl | 330 | C-I | 218 | H-F | 568 | ||
| C-O | 351 | H-O | 463 |
查看答案和解析>>
科目: 来源: 题型:推断题
 有A、B、C、D、E、F六种微粒,其中A~E五种微粒均由两种元素组成且均含10个电子,它们有如图所示的转化关系:
有A、B、C、D、E、F六种微粒,其中A~E五种微粒均由两种元素组成且均含10个电子,它们有如图所示的转化关系:查看答案和解析>>
科目: 来源: 题型:解答题
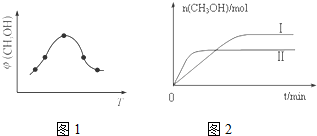
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2 3molH2 | a molCO2、b molH2、c molCH3OH(g)、c molH2O(g) (a、b、c均不等于0) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com