
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
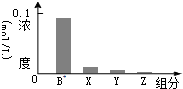 常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是 ( )
常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是 ( )| A. | HA为强酸 | B. | 该混合溶液中:c(A-)+c(Y)=c(Na+) | ||
| C. | 图中X表示HA,Y表示H+,Z表示OH- | D. | 该混合液pH=7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 15mol•L-1 | B. | 10mol•L-1 | C. | 5mol•L-1 | D. | 1mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 60% | B. | 75% | C. | 80% | D. | 85% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaCl | B. | KNO3 | C. | MgSO4 | D. | AlCl3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 物质所含元素化合价升高的反应是氧化反应 | |
| B. | 物质所含元素化合价降低的反应是还原反应 | |
| C. | 氧化剂本身被还原,具有氧化性;还原剂本身被氧化,具有还原性 | |
| D. | 氧化反应和还原反应不一定同时存在于一个反应中 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH4+、NO3-、Al3+、Cl- | B. | Na+、Al3+、S2-、NO3- | ||
| C. | MnO4-、K+、SO42-、Na+ | D. | K+、SO42-、HCO3-、Na+ |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂 | |
| B. | 上述反应中每生成2 mol AlN,N2得到3 mol | |
| C. | 氮化铝中氮元素的化合价为-3 | |
| D. | 氮化铝晶体属于分子晶体,熔点和沸点较低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com