
科目: 来源: 题型:解答题
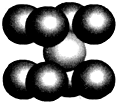 已知A、B、R、D都是周期表中前四周期的元素,它们的原子序数依次增大.其中A元素基态原子第一电离能比B元素基态原子的第一电离能大,B的基态原子的L层、R基态原子的M层均有2个单电子,D是第Ⅷ族中原子序数最小的元素.
已知A、B、R、D都是周期表中前四周期的元素,它们的原子序数依次增大.其中A元素基态原子第一电离能比B元素基态原子的第一电离能大,B的基态原子的L层、R基态原子的M层均有2个单电子,D是第Ⅷ族中原子序数最小的元素.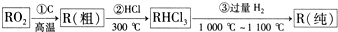
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 非自发的氧化还原反应不可以设计成原电池 | |
| B. | 将反应 3Cu+8HNO3═3Cu(NO3)2+2NO+4H2O 设计成原电池,其正极反应为:2NO3-+6e-+8H+═2NO+4H2O | |
| C. | 铅蓄电池工作时,正极、负极质量均增加 | |
| D. | 氢氧燃料电池耗H20.1mol时,电路中流经的电子数为0.1NA |
查看答案和解析>>
科目: 来源: 题型:解答题
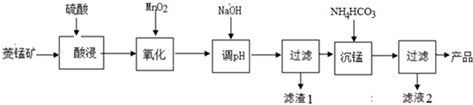
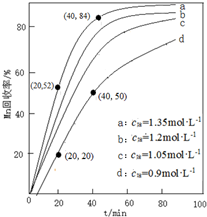
查看答案和解析>>
科目: 来源: 题型:解答题
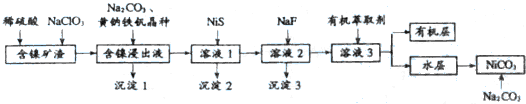
| 元素 | Na2+ | Fe3+ | Cu2+ | Ca2+ | Mg2+ | Zn2- |
| 浓度/g•L-1 | 5.25 | 0.47 | 0.30 | 0.40 | 0.18 | 0.81 |
| 开始沉淀PH | 6.4 | 2.2 | 4.7 | / | 9.6 | 6.5 |
| 完全沉淀PH | 8.4 | 3.5 | 6.7 | / | 11.6 | 8.5 |
| 难溶物 | NiS | CuS | ZnS | |
| 溶度积常数 | 1.07×10-21 | 1.27×10-26 | 2.93×10-25 | |
| 难溶物 | CaF2 | MgF2 | ZnF2 | NiF2 |
| 溶度积常数 | 1.46×10-10 | 7.42×10-11 | 3.04×10-2 | 微溶 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 化合物 | 密度/g•cm-3 | 沸点/℃ | 溶解性 |
| 正丁醇 | 0.810 | 118.0 | 可溶 |
| 冰醋酸 | 1.049 | 118.1 | 互溶 |
| 乙酸正丁酯 | 0.882 | 126.1 | 微溶 |
| 乙醇 | 0.79 | 78.5 | 互溶 |
| 乙酸乙酯 | 0.88 | 77.06 | 可溶 |
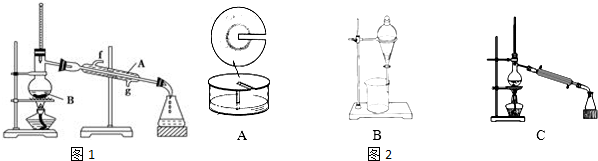
查看答案和解析>>
科目: 来源: 题型:解答题
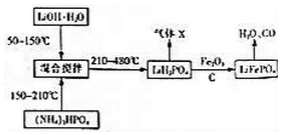
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com