
科目: 来源: 题型:选择题
| A. | 人类目前所利用的能量大部分是由化学反应产生的 | |
| B. | 煤、石油、天然气是当今世界最重要的三种化石燃料 | |
| C. | 我国目前最主要的能源是石油 | |
| D. | 能量变化是化学反应的基本特征之一 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 温室效应 | B. | 氮的氧化物排放 | C. | 白色污染 | D. | 对臭氧层的破坏 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 有毒的 | B. | 单质 | C. | 氧化物 | D. | 金属或合金 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 工业废水经处理达标后再排放 | B. | 农业生产中农药、化肥正确使用 | ||
| C. | 禁止使用化肥、农药 | D. | 城市垃圾妥善处理 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | (a+0.5b-1.5c) kJ•mol-1 | B. | (a-0.5b+1.5c) kJ•mol-1 | ||
| C. | (2a+b-3c) kJ•mol-1 | D. | (2a+b+3c) kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:实验题
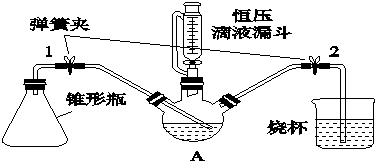
查看答案和解析>>
科目: 来源: 题型:实验题
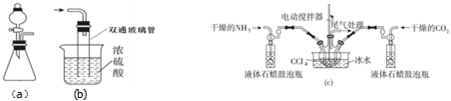
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题
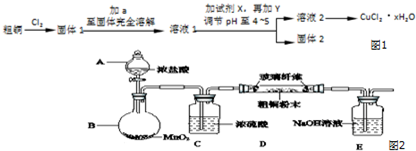
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com