
科目: 来源: 题型:解答题
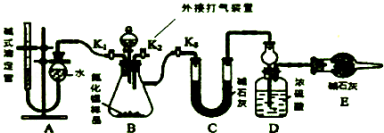
查看答案和解析>>
科目: 来源: 题型:实验题
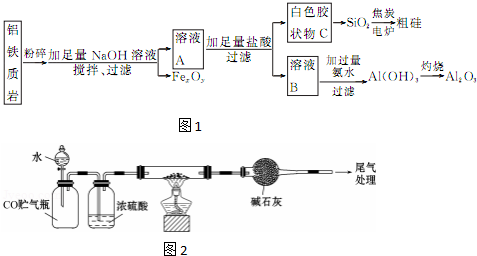
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | V(NaOH)=0时,c(H+)=1×10-2 mol/L | |
| B. | V(NaOH)=10 mL时,c(H+)=1×10-7 mol/L | |
| C. | V(NaOH)<10 mL时,可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) | |
| D. | V(NaOH)>10 mL时,2c(C2O42-)>c(Na+)>c(HC2O4-) |
查看答案和解析>>
科目: 来源: 题型:解答题
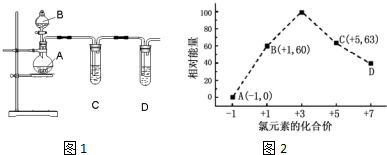
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol 羟基(-OH)所含的电子总数为9NA | |
| B. | 有14g乙烯与丙烯混合气体,其含原子总数为3NA个 | |
| C. | 室温下,8g甲烷中含有共价键数为2 NA | |
| D. | 在78g苯中含3NA个碳碳双键 |
查看答案和解析>>
科目: 来源: 题型:选择题
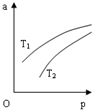 在密闭容器中发生反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ•mol-1,NH3 在 平衡混合气体中的体积分数(a)与温度(T)、压强(p)的关系如图所示.下列判 断正确的是( )
在密闭容器中发生反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ•mol-1,NH3 在 平衡混合气体中的体积分数(a)与温度(T)、压强(p)的关系如图所示.下列判 断正确的是( )| A. | T1>T2 | |
| B. | 其他条件不变,增大压强,可提高单位时间内 NH3的产量 | |
| C. | 升高温度,该反应的化学平衡常数增大 | |
| D. | 当 n(N2):n(H2):n(NH3)=1:3:2 时,反应一定达到平衡状态 |
查看答案和解析>>
科目: 来源: 题型:实验题
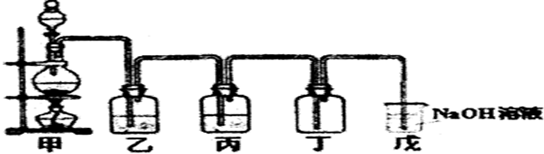
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯化铵与氢氧化钙混合加热:NH4++OH-=NH3↑+H2O | |
| B. | 铁片溶于足量稀硝酸:Fe+2H+=Fe2++H2↑ | |
| C. | 盐酸与AgNO3溶液反应:HCl+Ag+=H++AgCl↓ | |
| D. | 稀氨水与稀盐酸混合:NH3?H2O+H+=NH4++H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com