
科目: 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④ | C. | ①②④ | D. | ②④⑥ |
查看答案和解析>>
科目: 来源: 题型:解答题
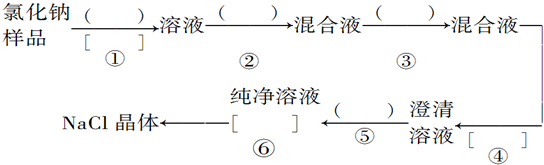
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验编号 | 1 | 2 | 3 | 4 | 5 |
| BaCl2溶液体积/mL | 0 | 20 | 40 | 100 | 120 |
| 沉淀质量/g | 0 | 0.233 | m | 0.699 | 0.699 |
| A. | 混合前,Na2SO4溶液的物质的量浓度为0.05mol/L | |
| B. | 混合前,BaCl2溶液的物质的量浓度为0.10mol/L | |
| C. | 3号实验中沉淀的质量m为0.398g | |
| D. | 完全沉淀60mLNa2SO4溶液消耗BaCl2溶液的体积为80mL |
查看答案和解析>>
科目: 来源: 题型:填空题
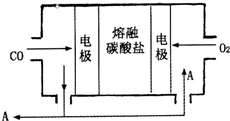 用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池的研究取得了重大突破.该电池示意图如图:负极电极反应式为2CO-4e-+2CO32-=4CO2,为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环.A物质的化学式为CO2.
用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池的研究取得了重大突破.该电池示意图如图:负极电极反应式为2CO-4e-+2CO32-=4CO2,为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环.A物质的化学式为CO2.查看答案和解析>>
科目: 来源: 题型:填空题
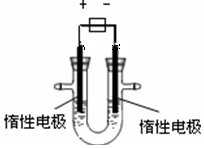
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 等物质的量浓度的HA溶液与MOH溶液等体积混合:c(H+)+c(M+)=c(OH-)+c(A-) | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(CH3COONa)<c(Na2CO3)<c(NaOH) | |
| C. | c(CH3COOH)=c(CH3COONa)溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) | |
| D. | 0.1 mol•L-1的NaHCO3溶液:c(Na+)>c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用25 mL量筒量取12.36 mL盐酸 | |
| B. | 用pH试纸测出某溶液pH为3.5 | |
| C. | 用托盘天平称取8.75 g食盐 | |
| D. | 用酸式滴定管测出消耗盐酸的体积为15.60 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com