
科目: 来源: 题型:填空题
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | E | |||||||
| 3 | A | C | D | G | ||||
| 4 | B | F |
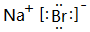 ,高温灼烧该化合物时,火焰呈黄色.
,高温灼烧该化合物时,火焰呈黄色.查看答案和解析>>
科目: 来源: 题型:解答题
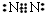 ;
;查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 化学反应过程中,一定有化学键的断裂和形成 | |
| B. | 日常生活中的废旧电池会污染环境,所以应集中填埋处理 | |
| C. | 化学反应过程中,分子的种类和数目一定发生改变 | |
| D. | 放热反应的反应速率,一定比吸热反应的反应速率快 |
查看答案和解析>>
科目: 来源: 题型:实验题

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
查看答案和解析>>
科目: 来源: 题型:实验题
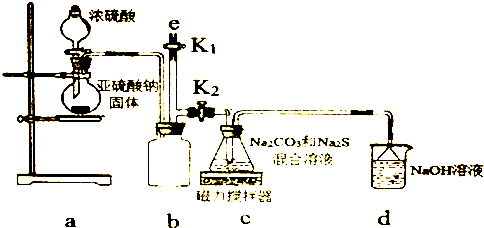
查看答案和解析>>
科目: 来源: 题型:实验题
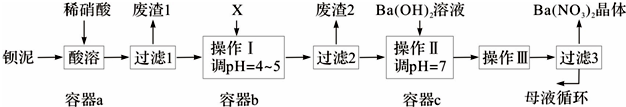
查看答案和解析>>
科目: 来源: 题型:实验题
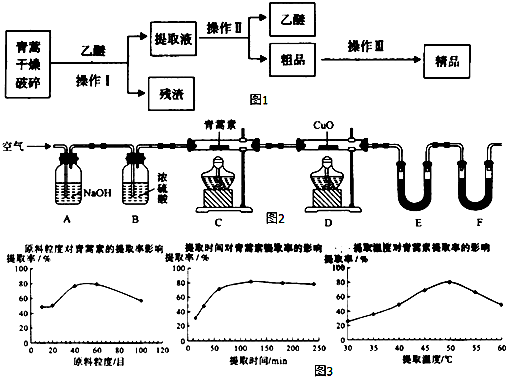
| 装置 | 实验前/g | 实验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
查看答案和解析>>
科目: 来源: 题型:实验题
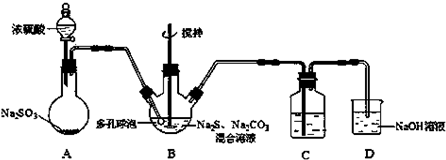
查看答案和解析>>
科目: 来源: 题型:实验题


查看答案和解析>>
科目: 来源: 题型:实验题
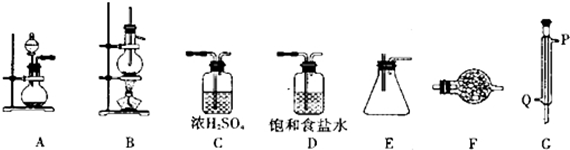
| 密度/(g•cm-3) | 熔点/℃ | 沸点/℃ | |
| 四氯化锡 | 2.2 | -33 | 114 |
| 金属锡 | 5.77 | 231 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com