
科目: 来源: 题型:实验题
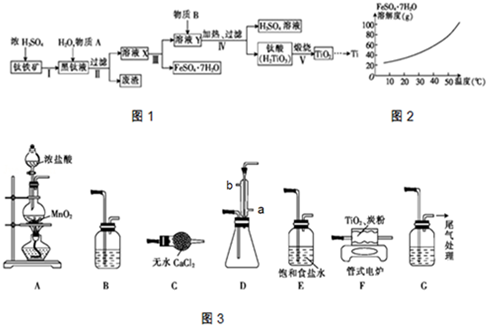
查看答案和解析>>
科目: 来源: 题型:实验题
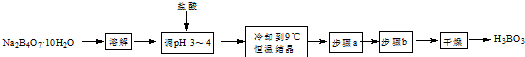
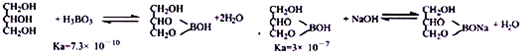
查看答案和解析>>
科目: 来源: 题型:实验题
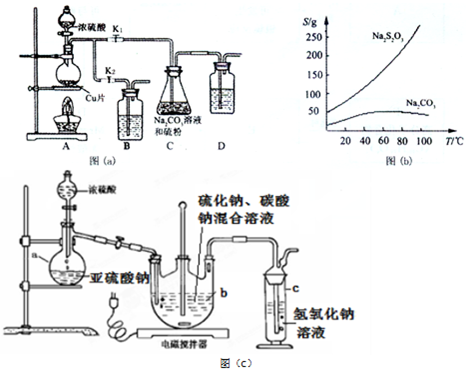
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  3-甲基-2-乙基戊烷 3-甲基-2-乙基戊烷 | |
| B. | (CH3)3CCH2CH(C2H5)CH3 2,2-二甲基-4-乙基戊烷 | |
| C. | 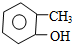 邻甲基苯酚 邻甲基苯酚 | |
| D. | 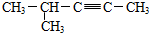 2-甲基-3-戊炔 2-甲基-3-戊炔 |
查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:选择题
| 序号 | 物质 | 杂质 | 除杂试剂或操作方法 |
| ① | NaCl溶液 | Na2CO3 | 加入盐酸,蒸发 |
| ② | FeSO4溶液 | CuSO4 | 加入过量铁粉并过滤 |
| ③ | H2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
| ④ | NaNO3 | CaCO3 | 加稀盐酸溶解、过滤、蒸发、结晶 |
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=+890.3 kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890.3 kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-890.3 kJ | |
| D. | 2H2(g)+O2(g)═2H2O(l);△H=-285.8 kJ |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-542.7 kJ/mol | |
| B. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1 059.3 kJ/mol | |
| C. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=+1 076.7 kJ/mol | |
| D. | N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-538.35kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com