
科目: 来源: 题型:实验题
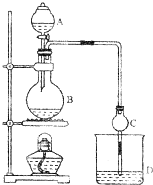 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、乙酸,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、乙酸,D中放有饱和碳酸钠溶液.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol•L-1 | B. | 2.5 mol•L-1 | C. | 5 mol•L-1 | D. | 2 mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢氧化钡溶液与硫酸混合:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 铁粉与硝酸银溶液反应:Fe+2Ag+═Fe2++2Ag | |
| C. | 氯化铝溶液与过量的氨水反应:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 氯气通入冷的氢氧化钠溶液中:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 先装好药品,再检查装置的气密性 | |
| B. | 先用双手握紧试管,再将导管插入水中检查装置气密性 | |
| C. | 结束氢气还原氧化铜的实验时,先熄灭酒精灯后撤出导管 | |
| D. | 稀释硫酸时,先在烧杯里倒入浓硫酸,再小心倒入水并不断搅拌 |
查看答案和解析>>
科目: 来源: 题型:推断题
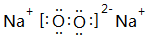 .
.查看答案和解析>>
科目: 来源: 题型:解答题
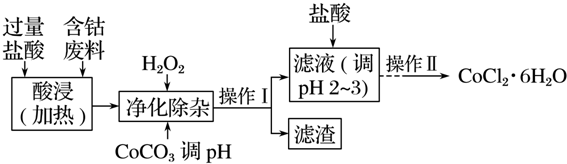
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
查看答案和解析>>
科目: 来源: 题型:解答题
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,c(H+)/c(OH一)=1×10-12的溶液:K+、AlO2-、SiO32-、Na+ | |
| B. | 加入KSCN显红色的溶液:K+、NH4+、Cl-、I- | |
| C. | 加入石蕊显蓝色的溶液:Cu2+、Al3+、NO3-、SO42- | |
| D. | 加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.22 mol/L | B. | 0.11 mol/L | C. | 0.022 mol/L | D. | 0.011 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com