
科目: 来源: 题型:选择题
| A. | 滴加甲基橙试液显红色的溶液 Fe3+、NH4+、Cl-、SCN- | |
| B. | 水电离出来的c(H+)=10-13mol/L的溶液 K+、HCO3-、Br-、Ba2+ | |
| C. | pH值为1的溶液 Cu2+、Na+、Mg2+、NO3- | |
| D. | 所含溶质为Na2SO4的溶液 K+、HCO3-、NO3-、H+ |
查看答案和解析>>
科目: 来源: 题型:解答题
| 杂质 | 加入试剂 | 化学方程式 |
| 硫酸盐 | ||
| MgCl2 | ||
| CaCl2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2的摩尔质量是2 g | B. | 1 mol H2O的质量是18 g/mol | ||
| C. | 氧气的摩尔质量是32 g/mol | D. | 2 g H2含1 mol H |
查看答案和解析>>
科目: 来源: 题型:实验题
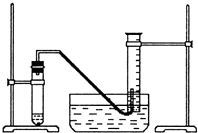 某学生利用锌与稀硫酸反应产生的氢气的体积,粗略测定锌的摩尔质量(设Wg锌片全部反应,产生气体的体积折算成标准状况时不超过50mL).实验装置如下:
某学生利用锌与稀硫酸反应产生的氢气的体积,粗略测定锌的摩尔质量(设Wg锌片全部反应,产生气体的体积折算成标准状况时不超过50mL).实验装置如下:查看答案和解析>>
科目: 来源: 题型:实验题
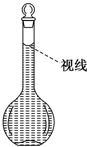 用18mol/L的浓硫酸配制80mL 1.0mol/L的稀硫酸,需用的实验仪器有:A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
用18mol/L的浓硫酸配制80mL 1.0mol/L的稀硫酸,需用的实验仪器有:A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶查看答案和解析>>
科目: 来源: 题型:实验题
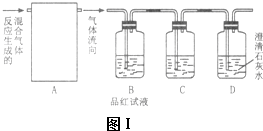
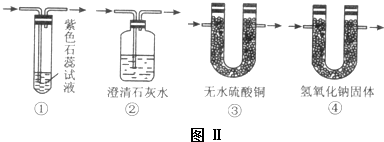
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | Tl+的最外层有1个电子 | B. | Tl3+的氧化性比Al3+强 | ||
| C. | Tl 能形成+3价和+1价的化合物 | D. | Tl+的还原性比Ag强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2O2 Al2(SO4)3 MgCl2 K2CO3 | B. | BaCl2 Na2SO4 (NH4)SO4 KOH | ||
| C. | AgNO3 NaCl KCl CuCl2 | D. | Fe2(SO4)3 K2CO3 KHSO4 NH4Cl |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com