
科目: 来源: 题型:选择题
| A. | 水电解生成氢气和氧气,说明水中含有氢分子和氧分子 | |
| B. | 用肥皂水不可以区分硬水和软水 | |
| C. | 将黄河水经沉降、过滤、吸附,灭菌等净化操作后,可供人们生活用水 | |
| D. | 水体有一定的自净功能,部分工业污水可直接排放 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 50(b-2a) | B. | (b-2a) | C. | 50(b-a) | D. | 10(b-2a) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 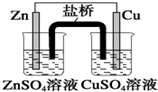 装置中,盐桥中的K+移向ZnSO4溶液 | |
| B. | 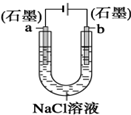 装置工作一段时间后,a极附近溶液的pH增大 | |
| C. | 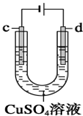 用装置精炼铜时,c极为精铜,电解过程中CuSO4溶液没有变化 | |
| D. | 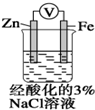 装置中电子由Zn流向Fe,装置中有Fe2+生成 |
查看答案和解析>>
科目: 来源: 题型:选择题
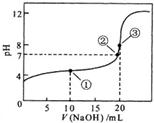 常温下,用0.1000mol/L NaOH溶液滴定 20.00mL 0.1000mol/L CH3COOH溶液的滴定曲线如图.下列说法不正确的是( )
常温下,用0.1000mol/L NaOH溶液滴定 20.00mL 0.1000mol/L CH3COOH溶液的滴定曲线如图.下列说法不正确的是( )| A. | 点①所示溶液中:2c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| B. | 点②所示溶液中:c(Na+)=c(CH3COO-) | |
| C. | 点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 检验NH4+:滴入NaOH溶液后,加热,用湿润红色石蕊试纸检验发现变蓝 | |
| B. | 检验Cl-:确定溶液中无SO42-后,加入AgNO3溶液后出现白色沉淀 | |
| C. | 检验Na+:将干净的铂丝蘸取少量溶液在酒精灯上灼烧,观察火焰呈浅紫色 | |
| D. | 检验SO42-:加入BaCl2溶液出现白色沉淀,再加足量稀盐酸沉淀不溶解 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氨因为有刺激性气味,因此不用来做制冷剂 | |
| B. | 浓硫酸稀释是往浓硫酸中慢慢倒入水,并用玻璃棒不断的搅拌 | |
| C. | 元素周期表中,族序数都等于该元素原子的最外层电子数 | |
| D. | 往水玻璃中通入CO2:Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓ 可证明碳酸的酸性强于硅酸的酸性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol Al3+离子含有的核外电子数为3NA | |
| B. | 常温常压下,22.4 L乙烯中C-H键数为4NA | |
| C. | 10 L pH=1的硫酸溶液中含有的H+离子数为2NA | |
| D. | 18gH2O中含有的质子数为10NA |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
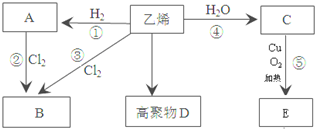
 ,C中所含官能团的名称羟基;
,C中所含官能团的名称羟基;查看答案和解析>>
科目: 来源: 题型:推断题
 ,工业冶炼单质E的化学方程式2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
,工业冶炼单质E的化学方程式2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com