
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
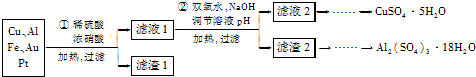
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | MgCl2+Ba(OH)2═BaCl2+Mg(OH)2↓ | B. | CO2+2NaOH═Na2CO3+H2O | ||
| C. | CaCO3 $\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | D. | H2+CuO $\frac{\underline{\;\;△\;\;}}{\;}$H2O+Cu |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 将稀硫酸和Na2S反应生成的气体通入AgNO3与AgCl组成的浊液中 | Ksp(AgCl)>Ksp(Ag2S) |
| B | 室温下,向浓度均为0.1 mol•L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀. | Ksp(BaSO4)<Ksp(CaSO4) |
| C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色. | Fe3+的氧化性比I2的强 |
| D | 室温下,用pH试纸测得0.1mol•L-1 Na2SO3溶液的pH约为10;0.1mol•L-1 NaHSO3溶液的pH约为5. | HSO3-结合H+的能力比SO32-的强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似 | |
| B. | Zn2+的最外层电子排布式为3s23p63d10 | |
| C. | 基态铜原子的外围电子排布图: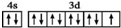 | |
| D. | 基态碳原子的最外层电子排布图: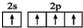 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com