
科目: 来源: 题型:解答题
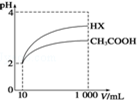 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目: 来源: 题型:解答题
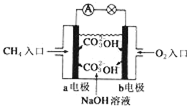 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
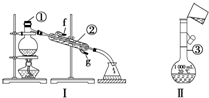 掌握仪器的名称及使用方法是化学实验的基础,如图所示为两套实验装置.
掌握仪器的名称及使用方法是化学实验的基础,如图所示为两套实验装置.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 22.4 L CO和CO2的混合气体中所含的碳原子数一定是NA | |
| B. | 标准状况下,22.4 L氖气含有原子数为NA | |
| C. | 物质的量浓度为2 mol/L的BaCl2溶液中,含有Cl-个数为4NA | |
| D. | 标准状况下,11.2 L H2O含有0.5NA分子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将322 g Na2SO4•10H2O溶于1 L水中,所得溶液的物质的量浓度为1 mol/L | |
| B. | 将含2 mol H2SO4的溶液加水稀释到2 L,所得溶液中H2SO4的物质的量浓度为1 mol/L | |
| C. | 将1 L 18.4 mol/L的H2SO4溶液加入1 L水中,所得溶液的物质的量浓度为9.2 mol/L | |
| D. | 将336 mL HCl气体溶于300 mL水,所得溶液的物质的量浓度为0.05 mol/L |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Fe3+>MnO4->Cl2>Cu2+ | B. | MnO4->Cl2>Fe3+>Cu2+ | ||
| C. | Cl2>MnO4->Fe3+>Cu2+ | D. | Cu2+>Cl2>MnO4->Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com