
科目: 来源: 题型:解答题
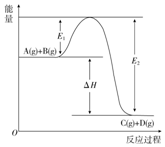 反应A(g)+B(g)═C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)═C(g)+D(g)过程中的能量变化如图所示,回答下列问题.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用HR做导电实验,灯泡很暗 | |
| B. | 0.1mol•L-1HR溶液稀释到100倍时,溶液的pH值为3 | |
| C. | 20mL0.1mol•L-1HR恰好中和20mL0.1mol•L-1NaOH溶液 | |
| D. | 0.1mol•L-1NH4R溶液的pH等于7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用托盘天平称取11.7gNaCl | |
| B. | 用50mL量筒量取21.48mL稀硫酸 | |
| C. | 用碱式滴定管量取25.03mLH2SO4溶液 | |
| D. | 用pH试纸测定HNO3溶液的pH=3.7 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| B. | 小苏打用于治疗胃溃疡病人的胃酸过多症 | |
| C. | 计算机芯片所用的材料是高纯度的二氧化硅 | |
| D. | 捕获工业排放的CO2能降低地球的温室效应 |
查看答案和解析>>
科目: 来源: 题型:解答题
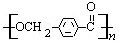 的路线:
的路线: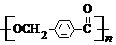
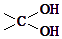 →
→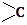 ═O+H2O
═O+H2O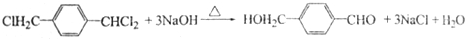 ;该反应过程中生成的不稳定中间体的结构简式应是
;该反应过程中生成的不稳定中间体的结构简式应是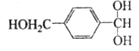 .
.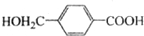 ,D的同分异构体中含有苯环且水解产物之一为乙酸的有3种,写出其中的一种结构简式:
,D的同分异构体中含有苯环且水解产物之一为乙酸的有3种,写出其中的一种结构简式: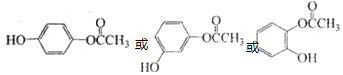 .
.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
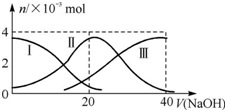 常温下,向20mL 0.2mol•L-1 H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如图所示.根据图示判断下列说法正确的是( )
常温下,向20mL 0.2mol•L-1 H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如图所示.根据图示判断下列说法正确的是( )| A. | 当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-) | |
| B. | 等浓度的NaOH溶液与H2A溶液按2:1混合后,其溶液中水的电离程度比纯水小 | |
| C. | NaHA溶液中:c(OH-)+c(A2-)=c(H+)+c(H2A) | |
| D. | 向上述加入20 mL NaOH溶液后所得溶液中再加入水的过程中,pH可能减小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na+、SO42-、Ba2+、Cl- | B. | Na+、K+、CH3COO-、NO3- | ||
| C. | H+、Cu2+、OH-、CO32- | D. | K+、Na+、Cl-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com