
科目: 来源: 题型:解答题
| 主族族数 周期序数 | ||||||||
| ⑤ | ⑥ | ⑧ | ||||||
| ① | ③ | ④ | ⑦ | ⑩ | ||||
| ② | ⑨ |
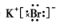 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 漂白粉是混合物,有效成分是Ca(ClO)2 | |
| B. | 光照氯水有气泡逸出,该气体是Cl2 | |
| C. | Cl2能使湿润的有色布条褪色,说明Cl2具有漂白性 | |
| D. | 实验室用二氧化锰与稀盐酸反应制取Cl2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 聚乳酸是一种纯净物 | |
| B. | 聚乳酸的聚合方式与聚苯乙烯相似 | |
| C. | 聚乳酸的单体为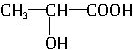 | |
| D. | 聚乳酸的降解过程不需要其他物质参与反应 |
查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:填空题
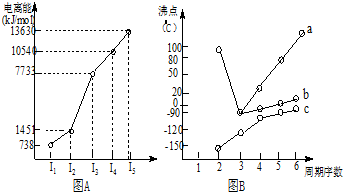
| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 | 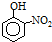 | 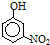 | 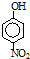 |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
查看答案和解析>>
科目: 来源: 题型:填空题
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 50mL溶液中,2 mol•L-1NaCl溶液和1 mol•L-1CaCl2溶液中的c(Cl-)相等 | |
| B. | 1 mol CO2的质量为44g/mol | |
| C. | 不同物质的摩尔质量必定不相等 | |
| D. | O2的摩尔体积约为22.4 L |
查看答案和解析>>
科目: 来源: 题型:推断题
 ,可以证明该结论的实验是(用离子方程式表示)Cl2+S2-=2Cl-+S↓.
,可以证明该结论的实验是(用离子方程式表示)Cl2+S2-=2Cl-+S↓.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
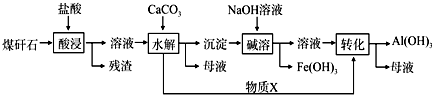
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com