
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
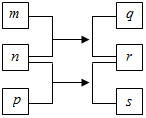 短周期元素W、X、Y、Z的原子序数依次增加.n、p、q是由这些元素组成的二元化合物,m是元素Y的单质,p是一种淡黄色粉末,q的水溶液可在玻璃器皿上蚀刻标记,0.01mol•L-1s溶液的pH为12,上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.n、p、q是由这些元素组成的二元化合物,m是元素Y的单质,p是一种淡黄色粉末,q的水溶液可在玻璃器皿上蚀刻标记,0.01mol•L-1s溶液的pH为12,上述物质的转化关系如图所示.下列说法正确的是( )| A. | 离子半径:X>Y>Z | |
| B. | 氧化性:r>m | |
| C. | p和q中均含有离子键 | |
| D. | 等体积等浓度的q溶液与s溶液反应后,溶液呈中性 |
查看答案和解析>>
科目: 来源: 题型:填空题
 “细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,如溶液中的氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图所示:
“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,如溶液中的氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图所示:查看答案和解析>>
科目: 来源: 题型:选择题
| 化学方程式 | F2+H2?2HF | H2+Cl2?2HCl | H2+Br2(g)?2HBr | H2+I2(g)?2HI(g) |
| 平衡常数K(t1) | 1.8×1036 | 9.7×1012 | 5.6×107 | 43 |
| 平衡常数K(t2) | 1.9×1032 | 4.2×1011 | 9.3×106 | 34 |
| A. | 只有ab | B. | 只有abe | C. | 只有abce | D. | abcde |
查看答案和解析>>
科目: 来源: 题型:填空题
| 元素编号 | 元素性质或原子结构 |
| T | 失去一个电子后,形成Ne原子电子层结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 其单质之一是空气中主要成分,最常见的助燃剂 |
| Z | 形成双原子单质分子,黄绿色气体 |
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 苯不能使酸性高锰酸钾溶液褪色,所以苯不能发生氧化反应 | |
| B. | 石油的主要成分是烃,煤经过分馏可制得焦炭、煤焦油等产品 | |
| C. | 丙烯分子中所有原子不可能在同一平面上 | |
| D. | 石油裂解的目的是为了提高轻质液体燃料的产量和质量 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | $\frac{m{N}_{A}}{18n}$ | B. | $\frac{18m{N}_{A}}{n}$ | C. | 18mnNA | D. | $\frac{n{N}_{A}}{18n}$ |
查看答案和解析>>
科目: 来源: 题型:选择题
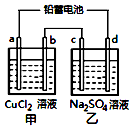 用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )| A. | d极为阴极 | |
| B. | 放电时铅蓄电池负极的电极反应式为:PbO2+4H++SO42-+4e-=PbSO4+2H2O | |
| C. | 若四个电极材料均为石墨,当析出6.4gCu时,消耗H2SO40.2mol | |
| D. | 甲池中阳离子向b极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com