
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
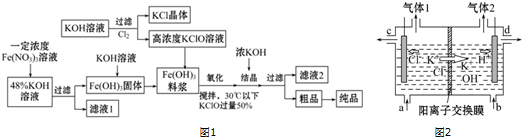
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
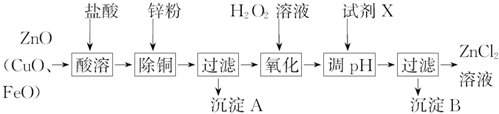
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.9 | 3.2 |
| Zn2+ | 5.2 | 6.4 |
| Fe2+ | 5.8 | 9.7 |
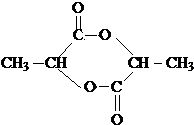 ,聚乳酸的结构简式为
,聚乳酸的结构简式为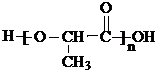 .
.查看答案和解析>>
科目: 来源: 题型:解答题
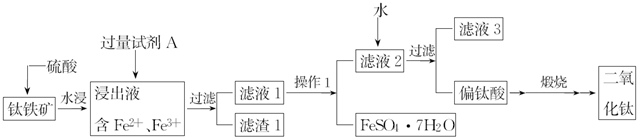
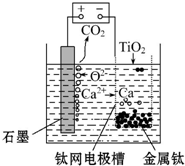
查看答案和解析>>
科目: 来源: 题型:解答题
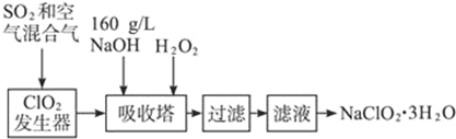
查看答案和解析>>
科目: 来源: 题型:解答题
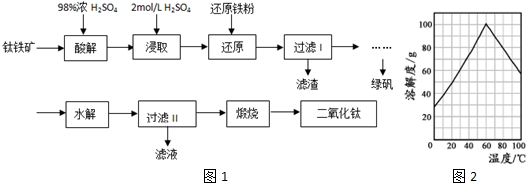
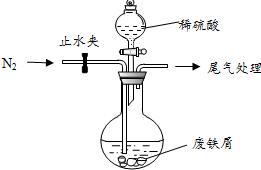 绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:
绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:查看答案和解析>>
科目: 来源: 题型:解答题
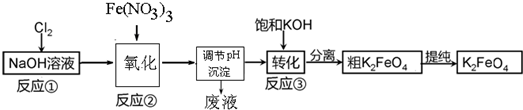

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | HNO3作氧化剂 | |
| B. | 氧化剂和还原剂的物质的量之比为1:1 | |
| C. | 当生成1molI2时,转移2mol电子 | |
| D. | 由该反应可知还原性:Se>KI |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com