
科目: 来源: 题型:解答题
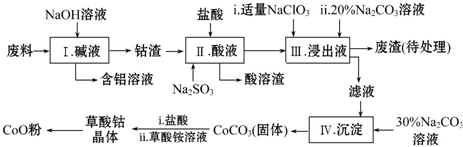
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 5.2 |
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
查看答案和解析>>
科目: 来源: 题型:解答题
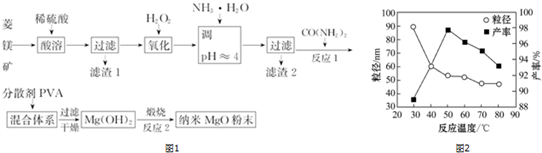
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
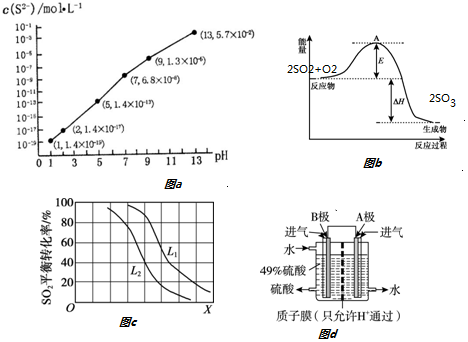
查看答案和解析>>
科目: 来源: 题型:解答题
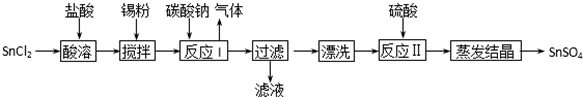
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2△H和2K | B. | -2△H和K2 | C. | 2△H和-2K | D. | -2△H和K-2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 把浑浊的液体倒入蒸发皿中加热 | B. | 开始析出晶体后用玻璃棒搅拌 | ||
| C. | 待水分完全蒸干后停止加热 | D. | 蒸发皿中出现多量固体时停止加热 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该温度下,反应的平衡常数是$\frac{1}{64}$ | |
| B. | 0~2min内,HI的平均反应速率为0.1mol•L-1•min-1 | |
| C. | 在恒容条件下,向该体系中充入HI气体,平衡不移动,反应速率不变 | |
| D. | 升高温度,平衡向正反应方向移动,只有正反应速率加快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com