
科目: 来源: 题型:选择题
| A. | 用红色石蕊试纸检验溶液的酸性 | |
| B. | 用苯萃取碘水中的碘单质,液体分层,上层为紫红色 | |
| C. | 蒸馏时温度计的水银球应插在液面下 | |
| D. | 食用油和水分离,四氯化碳和水分离,均可用分液漏斗,且油层从下口流出 |
查看答案和解析>>
科目: 来源: 题型:实验题
 如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
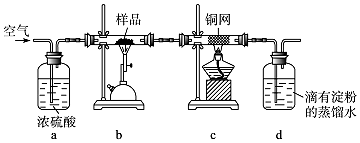
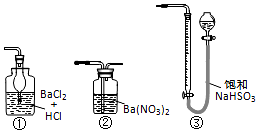
查看答案和解析>>
科目: 来源: 题型:解答题
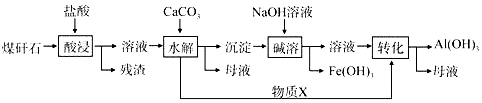
查看答案和解析>>
科目: 来源: 题型:解答题
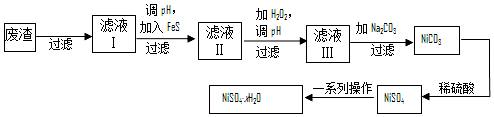
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | KClO3═K++3O2-+Cl5+ | B. | NaHCO3═Na++H++CO32- | ||
| C. | NaHS?Na++HS- | D. | HCO3-?H++CO32- |
查看答案和解析>>
科目: 来源: 题型:实验题
 某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL,分别进行了如下实验:
某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL,分别进行了如下实验:| 操作 | 现象 |
| a.测溶液pH,并向其中滴加2滴酚酞 | pH=3,溶液变红,5min后褪色 |
| b.向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
| 操作 | 现象 |
| 取5mLpH=13NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.24mol | B. | 0.21mol | C. | 0.25mol | D. | 0.12mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 5.6 g铁与足量盐酸反应生成H2的体积为2.24 L | |
| B. | 32 g臭氧(O3)含的原子数目为3NA | |
| C. | 标准状况下,11.2 L CCl4所含的原子数目为1.5NA | |
| D. | 常温常压下,46g NO2和N2O4混合气体所含的原子数目为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com