
科目: 来源: 题型:实验题
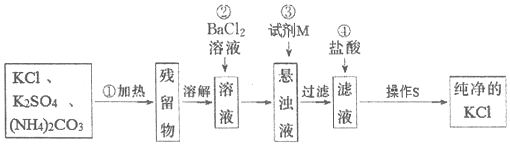
查看答案和解析>>
科目: 来源: 题型:解答题
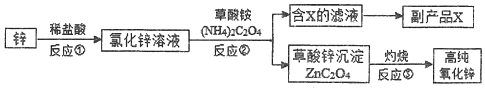
查看答案和解析>>
科目: 来源: 题型:多选题
| 选项 | 物质 | 杂质 | 除杂试剂 | 除去杂质的方法 |
| A | NaCl溶液 | BaCl2 | Na2CO3溶液 | 过滤 |
| B | NaCl溶液 | I2 | CCl4 | 多次萃取、分液 |
| C | CCl4 | 汽油 | H2O | 分液 |
| D | CO2 | HCl | NaOH溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:推断题
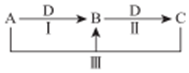 A、B、C、D 都是中学化学中常见物质,其中 A、B、C 均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).
A、B、C、D 都是中学化学中常见物质,其中 A、B、C 均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 18 g H2O中含NA个质子 | |
| B. | 1 L 1 mol•L-1的CuSO4溶液中含NA个Cu2+ | |
| C. | 常温常压下,2.24 L Cl2中含0.2NA个氯原子 | |
| D. | 0.5 mol Al与足量NaOH溶液充分反应,转移的电子数目为1.5NA |
查看答案和解析>>
科目: 来源: 题型:实验题
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
 在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:查看答案和解析>>
科目: 来源: 题型:实验题
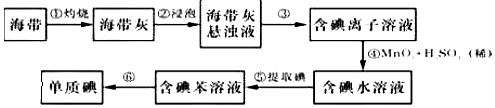
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaCl溶液(BaCl2):加过量Na2CO3溶液,过滤,再加适量盐酸并加热 | |
| B. | KNO3溶液(NaCl):加热蒸发得浓溶液后,降温 | |
| C. | NaCl溶液(Br2):加CCl4,分液 | |
| D. | KNO3溶液(AgNO3):加过量KCl溶液,过滤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com