
科目: 来源: 题型:选择题
| A. | 标准状况下,0.1 mol/L CH3COONa溶液中,CH3COO-个数小于0.1NA | |
| B. | K、Zn分别与稀硫酸反应所得溶液均呈中性 | |
| C. | Fe分别与氯气和稀盐酸反应所得氯化物相同 | |
| D. | C、P、S、Cl的最高价氧化物对应水化物的酸性逐渐增强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 浓硫酸、浓盐酸和浓硝酸长期暴露在空气中,质量都会减小、浓度都会降低 | |
| B. | 氯水和活性炭都可使红墨水褪色,其原理相同 | |
| C. | 浓硝酸见光会分解,故有时在实验室看到的浓硝酸呈黄色 | |
| D. | 浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应 |
查看答案和解析>>
科目: 来源: 题型:多选题
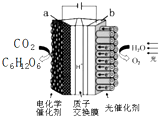 中关村“创客19”实验室模拟光合作用的电化学实验装置如右图所示,该装置能将H2O和CO2转化为O2和葡萄糖(C6H12O6).下列说法正确的是( )
中关村“创客19”实验室模拟光合作用的电化学实验装置如右图所示,该装置能将H2O和CO2转化为O2和葡萄糖(C6H12O6).下列说法正确的是( )| A. | 该装置是新型化学电源装置 | |
| B. | 该装置工作时,H+从a极区向b极区迁移 | |
| C. | 每生成1 mol O2,有44 g CO2被还原 | |
| D. | a 电极的反应为:6CO2+24H+-24e-=C6H12O6+6 H2 O |
查看答案和解析>>
科目: 来源: 题型:推断题
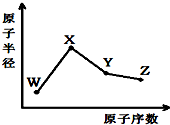 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.回答下列问题:
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.回答下列问题: .
.查看答案和解析>>
科目: 来源: 题型:选择题
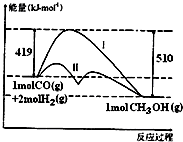 对于反应CO(g)+2H2(g)?CH3OH(g)△H,反应过程中的能量变化情况如图所示,曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )
对于反应CO(g)+2H2(g)?CH3OH(g)△H,反应过程中的能量变化情况如图所示,曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )| A. | 该反应的△H=+91kJ/mol | |
| B. | 加入催化剂,该反应的△H变小 | |
| C. | 反应物的总能量大于生成物的总能量 | |
| D. | 如果该反应生成液态CH3OH时为△H1,则△H1>△H |
查看答案和解析>>
科目: 来源: 题型:填空题
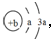 ,Y、Z为同周期金属元素,其中Y为短周期元素中原子半径最大的元素,Z为地壳中含量最高的金属元素,W的最高价氧化物对应水化物可以与其气态氢化物反应生成盐G,盐G溶液呈酸性,回答下列问题:
,Y、Z为同周期金属元素,其中Y为短周期元素中原子半径最大的元素,Z为地壳中含量最高的金属元素,W的最高价氧化物对应水化物可以与其气态氢化物反应生成盐G,盐G溶液呈酸性,回答下列问题: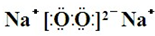 ,所含有的化学键类型为离子键和共价键.
,所含有的化学键类型为离子键和共价键.查看答案和解析>>
科目: 来源: 题型:推断题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com