
科目: 来源: 题型:选择题
| A. | 常温下含有NA个NO2、N2O4分子的混合气体,降温至标准状况,其体积小于22.4 L | |
| B. | 相同条件下,1 L CO和H2的混合气体完全燃烧消耗0.5 L O2 | |
| C. | 标准状况下,44.8 L NO与22.4 L O2充分反应后得到的气体分子数小于2NA | |
| D. | 在常温常压下,2.24 L SO2与O2的混合气体中所含氧原子数为0.2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Fe2+ NO3- I-SO42- | B. | MnO4- K+NO3-Na+ | ||
| C. | K+Al3+Cl-SO42- | D. | Mg2+SO32-Br-Ba2+ |
查看答案和解析>>
科目: 来源: 题型:解答题
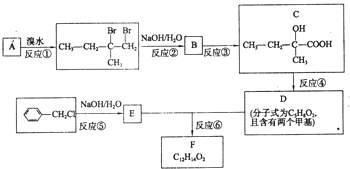 分子式为C12H14O2的有机物F广泛用于制备香精的调香剂.为了合成该有机物,某实验室的科技人员设计了下列合成路线.
分子式为C12H14O2的有机物F广泛用于制备香精的调香剂.为了合成该有机物,某实验室的科技人员设计了下列合成路线.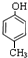 .
.查看答案和解析>>
科目: 来源: 题型:解答题
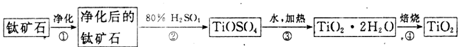
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释 |
| A | 在密闭容器中加热CuO制1000℃ | 黑色固体变成红色固体 | CuO受热分解得到单质Cu |
| B | 将SO2通入品红溶液中 | 溶液褪色 | SO2具有漂白性 |
| C | 将Mg、Al与NaOH溶液组成原电池 | Al电极溶解 | Al比Mg金属活动性强 |
| D | 向某溶液中加入盐酸酸化的氯化钡溶液 | 有白色沉淀生成 | 该溶液中一定含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碳氢化合物就是我们所说的烃 | |
| B. | 这一发现可以为我们提供足够的化石燃料,从而减少开发新能源的投资 | |
| C. | 从石油中可以获得重要的有机化工原料--乙烯 | |
| D. | 相同质量的碳氢化合物中氢的质量分数越高,完全燃烧时消耗的O2越多 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 苯、乙醇、四氯化碳都是重要有机溶剂,都可用于提取碘水中的碘单质 | |
| B. | 在强碱性溶液中,[Al(OH)4]-、HCO3-、Na+、Ca2+可能同时大量共存 | |
| C. | 铁船底镶嵌锌块,构成原电池,锌作负极,以防船体被腐蚀 | |
| D. | 用量筒量取10.mL 1.0mol/L的盐酸于100mL溶液瓶中,加水稀释至刻度,可制得0.1mol/L的盐酸 |
查看答案和解析>>
科目: 来源: 题型:解答题
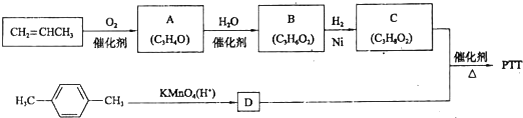
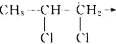
查看答案和解析>>
科目: 来源: 题型:实验题
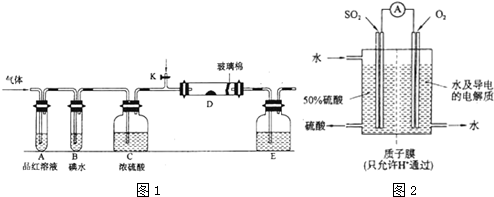
 2SO3.
2SO3.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 含有NH4+、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)>c(NH4+)>c(H+)<c(OH-) | |
| B. | pH=6的醋酸与醋酸钠的混合溶液中,c(Na+)>c(CH3COO-) | |
| C. | 0.1 mol/L 的Na2S溶液中,c(OH)=c(H+)+c(HS-)+2c(H2S) | |
| D. | pH=3的一元酸和pH=11的一元碱等体积混和后的溶液中,一定是c(OH-)=c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com