
科目: 来源: 题型:实验题
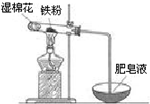 铁是日常生活中用途最广、用量最大的金属材料.
铁是日常生活中用途最广、用量最大的金属材料.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | FeO | B. | Fe2O3 | C. | Fe3O4 | D. | 无法确定 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2CO3、Na2SiO3 | B. | Na2CO3、SiO2 | C. | Na2SiO3 | D. | SiO2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用加热法测定胆矾晶体中结晶水含量时,若在空气中冷却会使结果偏低 | |
| B. | 配制氯化铁溶液时,先将氯化铁溶于较浓盐酸,再用蒸馏水稀释并加入少量铁粉 | |
| C. | 将甲烷和乙烯的混合气体通过盛有浓溴水的洗气瓶,即可提纯甲烷 | |
| D. | 将蔗糖和稀硫酸混合加热后,再加入银氨溶液并水浴加热,以检验还原性糖 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 珍珠、玛瑙、红宝石、水晶的主要成分都是硅酸盐 | |
| B. | 工业上冶炼金属Mg、Cu都采用热还原法 | |
| C. | 氯水、醋酸、小苏打都是电解质 | |
| D. | 利用丁达尔效应可以区别NaCl溶液和Fe(OH)3胶体 |
查看答案和解析>>
科目: 来源: 题型:解答题
 纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如表所示:
纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如表所示:| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
科目: 来源: 题型:实验题
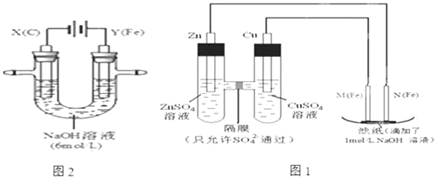
查看答案和解析>>
科目: 来源: 题型:实验题
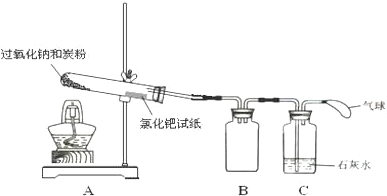
查看答案和解析>>
科目: 来源: 题型:推断题
 如下图的转化关系中,已知A是由短周期元素组成的酸式盐.D、Y、H为气体,X为无色液体,G和K均是常见的强酸.H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子.
如下图的转化关系中,已知A是由短周期元素组成的酸式盐.D、Y、H为气体,X为无色液体,G和K均是常见的强酸.H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子. ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com