
科目: 来源: 题型:选择题
| A. | 用分液漏斗分离乙醇与油脂的混合物 | |
| B. | 用玻璃棒蘸取次氯酸溶液点在干燥的pH试纸中部,测定次氯酸溶液的pH | |
| C. | 在含FeCl3杂质的MgCl2溶液中加入适量的MgCO3,微热,充分搅拌,静置,过滤得较纯净的MgCl2溶液 | |
| D. | 将甲烷与氯气按物质的量之比1:2通入烧瓶,光照,制取纯净的CH2Cl2 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验序号 | 实验内容 | 实验结果 |
| ① | 加AgNO3溶液 | 有白色沉淀生成 |
| ② | 加足量NaOH溶液并加热 | 收集到气体1.12L(标准状况) |
| ③ | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加入足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g;第二次称量读数为2.33g |
| 阴离子符号 | 物质的量浓度/mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Al3+ | B. | Fe2+ | C. | Fe3+ | D. | Cu2+ |
查看答案和解析>>
科目: 来源: 题型:解答题
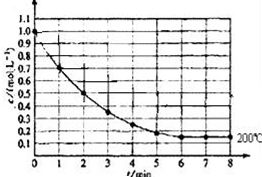 一固定体积的密闭容器中放入1molX(g)发生反应:X(g)?4Y(s)+Z(g),如图表示在 200℃时,X的浓度随时间变化的曲线.
一固定体积的密闭容器中放入1molX(g)发生反应:X(g)?4Y(s)+Z(g),如图表示在 200℃时,X的浓度随时间变化的曲线.查看答案和解析>>
科目: 来源: 题型:多选题
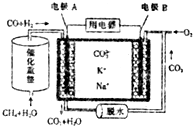
| A. | 电流方向:由B极经用电器流向A极 | |
| B. | 电极B上发生的电极反应为2CO2+O2+4e-═CO22- | |
| C. | 电池工作时,K+、Na+向电极B移动 | |
| D. | 若消耗电极B上的O233.6L(标准状况),则至少需要1moL CH4参加反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 11种 | B. | 10种 | C. | 9种 | D. | 8种 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 14g由N2和13C2H2组成的混合物所含的电子数为7NA | |
| B. | 标准状况下,11.2L NO与11.2L O2混合后所含的分子数小于0.75NA | |
| C. | 常温下,1L PH=3的Al2(SO4)3溶液中,水电离出的H+数目为10-3NA | |
| D. | 在100mL 1 mol•L-5 Na2S02溶液与1.12 L(标准状况)CL2的反应中,•还原剂失电子0.2NA |
查看答案和解析>>
科目: 来源: 题型:实验题
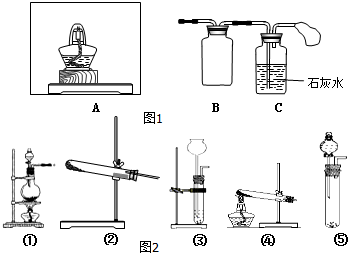 Na2O2是常见的氧化剂,某化学小组的同学欲通过以下实验确定炭粉与Na2O2反应的产物.
Na2O2是常见的氧化剂,某化学小组的同学欲通过以下实验确定炭粉与Na2O2反应的产物.查看答案和解析>>
科目: 来源: 题型:实验题
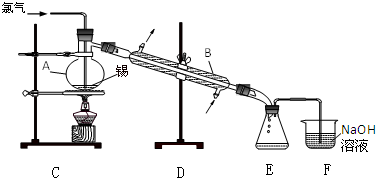
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com