
科目: 来源: 题型:选择题
| A. | 0.1 mol羟基( )中含有的电子数为0.7 NA )中含有的电子数为0.7 NA | |
| B. | 1 L 0.1 mol•L-1的AlCl3 溶液中含有Al3+的数目为0.1 NA | |
| C. | 0.1 mol N2与足量H2反应,转移的电子数为0.6 NA | |
| D. | 标准状况下,1.12 L HCHO中C原子的数目为0.05 NA |
查看答案和解析>>
科目: 来源: 题型:多选题
| 选项 | 操作及现象 | 溶 液 |
| A | 通入CO2,溶液变浑浊.再升温至65℃以上,溶液变澄清 | C6H5ONa溶液 |
| B | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失 | Na2SiO3溶液 |
| C | 通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失.再加入品红溶液,红色褪去 | Ca(ClO)2溶液 |
| D | 通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失.再加热溶液,又变浑浊 | CaCl2溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 二氧化锰具有强氧化性,能将双氧水氧化为氧气 | |
| B. | 硅为半导体,常用作光导纤维 | |
| C. | 炭具有强还原性,高温下能将二氧化硅还原为硅 | |
| D. | 二氧化硫具有漂白性,与氯水混合使用效果会更好 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 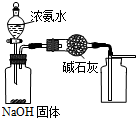 用图装置制取干燥纯净的NH3 | |
| B. | 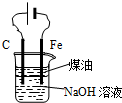 用图装置实验室制备Fe(OH)2 | |
| C. |  用图装置可以完成“喷泉”实验 | |
| D. |  用图装置测量Cu与浓硝酸反应产生气体的体积 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液中:NO3-、SO42-、Fe2+、Na+ | |
| B. | 强碱性溶液中:NH4+、NO3-、Ba2+、K+ | |
| C. | 澄清透明的溶液中:MnO4-、Al3+、SO42-、K+ | |
| D. | 含大量Fe3+的溶液中:Mg2+、Na+、Cl-、SCN- |
查看答案和解析>>
科目: 来源: 题型:解答题
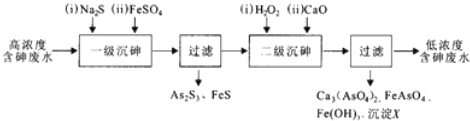
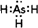
查看答案和解析>>
科目: 来源: 题型:解答题
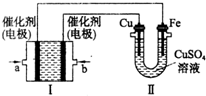 如图所示,装置1为甲烷燃料电池(电解质溶液为KOH溶液),通过装置II实现铁棒上镀铜.
如图所示,装置1为甲烷燃料电池(电解质溶液为KOH溶液),通过装置II实现铁棒上镀铜.查看答案和解析>>
科目: 来源: 题型:解答题
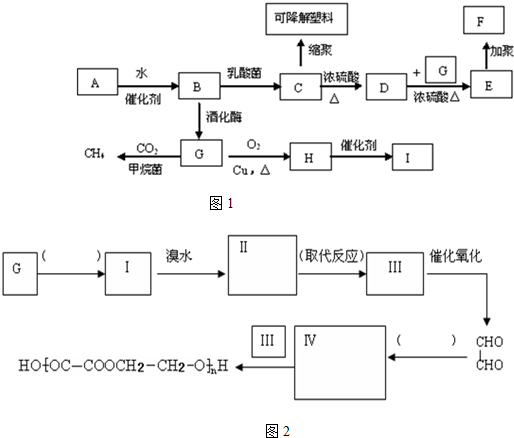
 六元环状化合物I
六元环状化合物I
 .
. 的合成路线如图2:(按要求填写,消去反应;氧化反应内填写反应类型,内填写Ⅱ和Ⅳ的结构简式)
的合成路线如图2:(按要求填写,消去反应;氧化反应内填写反应类型,内填写Ⅱ和Ⅳ的结构简式)查看答案和解析>>
科目: 来源: 题型:推断题
 已知两种常见金属A、B分别与两种酸X、Y发生反应各生成三种产物,其转化关系如图所示,其中G溶液呈蓝色.回答以下问题:
已知两种常见金属A、B分别与两种酸X、Y发生反应各生成三种产物,其转化关系如图所示,其中G溶液呈蓝色.回答以下问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(NH4+)相等的(NH4)2SO4溶液,(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl) | |
| B. | 0.1 mol/L的HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) | |
| C. | 0.1mol/L某二元弱酸强碱盐NaHA溶液中:c(Na+)=c(A2-)+c(HA-)+c(H2A) | |
| D. | 10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com