
科目: 来源: 题型:选择题

| A. | 滤液A中的阳离子为Fe2+、Fe3+、H+ | B. | 样品CuO的质量一定为4.0g | ||
| C. | 样品中Fe元素的质量为56V/22400g | D. | 样品中Fe元素的质量为2.24 g |
查看答案和解析>>
科目: 来源: 题型:解答题
 ;
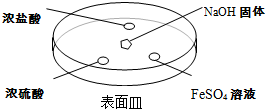
;
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.5molO3与11.2LO2所含的分子数一定相等 | |
| B. | 25℃与60℃时,水的pH相等 | |
| C. | 中和等体积、等物质的量的浓度的盐酸和醋酸所消耗的n(NaOH)相等 | |
| D. | 2SO2(g)+O2(g)=2SO3(g)和4SO2(g)+2O2(g)=4SO3(g)的△H相等 |
查看答案和解析>>
科目: 来源: 题型:解答题
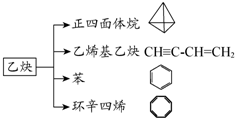 乙炔是一种重要的有机合成原料,以乙炔为原料在不同的反应条件下可以转化成如图所示的各种有机化合物.请回答下列问题:
乙炔是一种重要的有机合成原料,以乙炔为原料在不同的反应条件下可以转化成如图所示的各种有机化合物.请回答下列问题: -CH=CH2、
-CH=CH2、 的反应为取代反应
的反应为取代反应查看答案和解析>>
科目: 来源: 题型:解答题
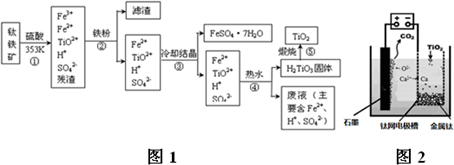
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 二氧化碳与石灰水:CO2+OH-=HCO3- | |
| B. | 氯化铁和硫氢化钠:2Fe3++2HS-=Fe2++2H++FeS↓+S↓ | |
| C. | 硫酸亚铁铵和氢氧化钡:2NH4++2OH-+Ba2++SO42-=2NH3•H2O+BaSO4↓ | |
| D. | 在酸性条件下亚硫酸钠和硫化钠:2SO32-+2S2-+8H+=3S↓+SO2↑+4H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验操作 | 实现现象 | 结论 | |
| A | 用饱和碳酸钠溶液浸泡锅炉沉积物后,过滤,洗涤,在所得沉淀物中再加入稀盐酸 | 有气泡产生 | 可除去锅炉沉淀物中的CaSO4 |
| B | 某充满NO2的密闭容器中,待反应平衡后,保持温度不变,扩大容器体积 | 气体颜色变浅 | 平衡2NO2(g)?N2O4(g)正向移动 |
| C | 向品红溶液中通入某气体 | 溶液褪色 | 该气体是SO2 |
| D | 用洁净铂丝蘸取溶液置于酒精灯火焰上灼烧 | 火焰呈黄色 | 溶液中含Na+,无K+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
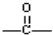
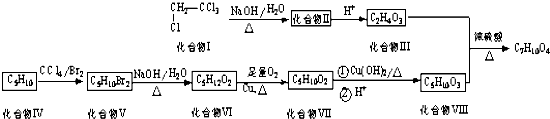
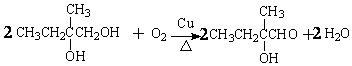 .
.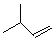 ,该六元环酯(C7H10O4)的结构简式为
,该六元环酯(C7H10O4)的结构简式为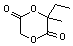 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com