
科目: 来源: 题型:选择题
| A. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,PM2.5比胶体粒子小,因其比表面积大,故可吸附重金属离子,入肺后对人体产生很大的危害 | |
| B. | 工业用石灰石、纯碱和石英在高温下制得玻璃的原理与硅酸和碳酸的酸性强弱无关 | |
| C. | 以NO和NO2为主的氮氧化物是形成光化学烟雾和酸雨的一个重要原因 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该反应中氧化剂只有FeCl3 | |
| B. | NaBH4的电子式为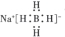 | |
| C. | NaBH4与稀硫酸不发生反应 | |
| D. | 该反应中每生成1 mol Fe,转移的电子数为3mol |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 生成气体的质量可能是11克或33克 | |
| B. | 滤渣中的红色物质可能是32克或96克 | |
| C. | 参与反应的氧化铜质量可能是40克或120克 | |
| D. | 稀硫酸的溶质质量可能是38.4克或115.2克 |
查看答案和解析>>
科目: 来源: 题型:推断题
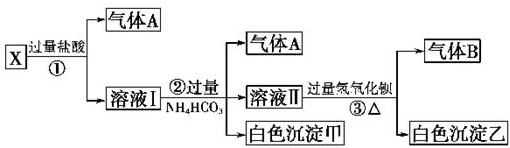
 ,已知断裂1mol B-B键吸收167kJ的热量,生成1mol B≡B键放出942kJ热量.试判断相同条件下B4与B2的稳定性顺序是:N4<N2.
,已知断裂1mol B-B键吸收167kJ的热量,生成1mol B≡B键放出942kJ热量.试判断相同条件下B4与B2的稳定性顺序是:N4<N2.查看答案和解析>>
科目: 来源: 题型:选择题
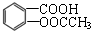 是一种常用的退热、镇痛药物,临床常用于预防心血管疾病.阿斯匹林对肠胃有一定的副作用,患有消化系统疾病的人不宜服用.则下列对此化合物说法不正确的是( )
是一种常用的退热、镇痛药物,临床常用于预防心血管疾病.阿斯匹林对肠胃有一定的副作用,患有消化系统疾病的人不宜服用.则下列对此化合物说法不正确的是( )| A. | 阿斯匹林能与NaHCO3反应,最多能与3mol H2发生加成反应 | |
| B. | 1 mol阿斯匹林与足量的NaOH溶液反应,消耗NaOH最大的物质的量为3 mol | |
| C. | 其苯环上的一氯取代物有两种 | |
| D. | 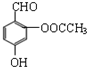 与阿斯匹林互为同分异构体,该有机物遇FeCl3溶液显紫色 与阿斯匹林互为同分异构体,该有机物遇FeCl3溶液显紫色 |
查看答案和解析>>
科目: 来源: 题型:实验题
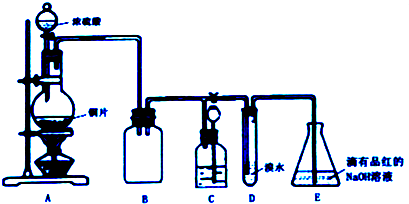
| 实验序号 | 实验操作 | 现象 | 反应的可能情况 |
| ① | 滴加少量淀粉碘化钾溶液,振荡 | III | |
| ② | 滴加少量棕红色的KI3溶液,振荡 | II | |
| ③ | 滴入加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 | |
| ④ | 加入几小块CaCO3固体 | 有气泡产生 |
查看答案和解析>>
科目: 来源: 题型:解答题
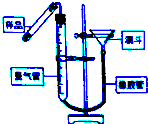 过氧化钙(CaO2•8H2O)是一种在水产养殖中广泛使用的供氧剂.
过氧化钙(CaO2•8H2O)是一种在水产养殖中广泛使用的供氧剂.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2O2、Na2O2都属于过氧化物,都存在非极性共价键 | |
| B. | 1mol H2O2在参加反应时可能转移lmol或2mol电子 | |
| C. | H2O2在酶作用下催化分解,随着温度的升高,分解速率持续加快 | |
| D. | H2O2做漂白剂是利用其氧化性,漂白原理与HClO类似、与SO2不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com