
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O═Fe(OH)2↓+2HC1O | |
| B. | NH4HSO3溶液与足量NaOH溶液反应:NH4++OH-═NH3↑+H2O | |
| C. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | 将1 mol•L-1NaAlO2溶液和1.5 mol•L-1的HC1溶液等体积混合:6AlO2-+9H++3H2O═5Al(OH)3↓+Al3+ |
查看答案和解析>>
科目: 来源: 题型:推断题
 .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题
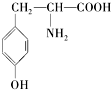 营养品和药品都是保证人类健康不可缺少的物质,其性质和制法是化学研究的主要内容.已知酪氨酸是一种生命活动不可缺少的氨基酸,它的结构简式是:
营养品和药品都是保证人类健康不可缺少的物质,其性质和制法是化学研究的主要内容.已知酪氨酸是一种生命活动不可缺少的氨基酸,它的结构简式是: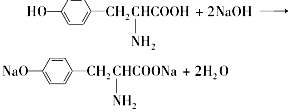 .
.查看答案和解析>>
科目: 来源: 题型:解答题
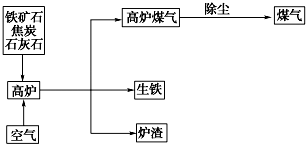
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
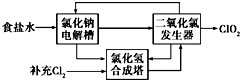 二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.
二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.查看答案和解析>>
科目: 来源: 题型:解答题
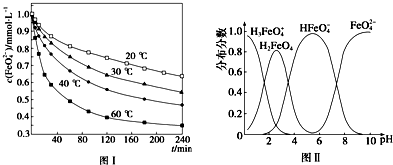
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com