
科目: 来源: 题型:选择题
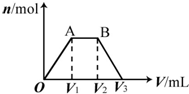 有KOH和Ca(OH)2的混合溶液,pH=13.取此溶液500mL,向其中通入CO2,通入CO2的体积(V)和生成沉淀的物质的量(n)的关系如图所示.图中(V1)为112mL(标准状况),则图中V2、V3的体积(单位为mL)分别是( )
有KOH和Ca(OH)2的混合溶液,pH=13.取此溶液500mL,向其中通入CO2,通入CO2的体积(V)和生成沉淀的物质的量(n)的关系如图所示.图中(V1)为112mL(标准状况),则图中V2、V3的体积(单位为mL)分别是( )| A. | 560、672 | B. | 1008、1120 | C. | 2240、2352 | D. | 392、504 |
查看答案和解析>>
科目: 来源: 题型:解答题
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7 | 4.7 |
| 氢氧化物沉淀完全时的pH | 3.2 | 9 | 6.7 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.2 mol•L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | 叠氮酸(HN3)与醋酸酸性相似,NaN3水溶液中离子浓度大小顺序为c(Na+)>c(N3-)>c(OH-)>c(H+) | |
| C. | 常温下向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-) | |
| D. | 常温下,等pH的CH3COONa、NaHCO3、NaClO三种溶液的浓度大小关系为c(NaClO)>c(NaHCO3)>c(CH3COONa) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.10 mol•L-1AgNO3溶液 | B. | 0.10 mol•L-1ZnSO4溶液 | ||
| C. | 0.20 mol•L-1CuCl2溶液 | D. | 0.20 mol•L-1Mg(NO3)2溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 等物质的量浓度的NaCl和AlCl3混合液完全电解后,所得的混合液的pH值增大 | |
| B. | NaCl溶液电解一定时间后,要恢复到电解前状态,应加入适量盐酸 | |
| C. | Na2SO4溶液在电解过程中,阴极区pH值降低 | |
| D. | 电解CuSO4溶液,阳极反应式为:2H2O+O2+4e-=4OH- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.01mol/L CH3COOH溶液 | B. | 0.01mol/L HNO3溶液 | ||
| C. | pH=2的H2SO4溶液 | D. | pH=2的CH3COOH溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C(HCO3-)=0.1mol/L的溶液中:NH4+、Al3+、Cl-、NO3- | |
| B. | 室温下,PH=2的溶液中:Fe2+、SO42-、Na+、NO3- | |
| C. | 无色透明的溶液中:NH4+、Cl-、NO3-、Fe3+ | |
| D. | 使红色石蕊试纸变蓝的溶液中:SO32-、Na+、CO32-、K+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| v(mol•L-1•s-1) | c(H2)(mol•L-1) | c(Cl2)(mol•L-1) |
| 1.0k | 1.0 | 1.0 |
| 2.0k | 2.0 | 1.0 |
| 4.0k | 2.0 | 4.0 |
| A. | m=1,n=1 | B. | m=$\frac{1}{2}$,n=$\frac{1}{2}$ | C. | m=$\frac{1}{2}$,n=1 | D. | m=1,n=$\frac{1}{2}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com