
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| B. | 标准状况下,22.4L盐酸含有NA个HC1分子 | |
| C. | 1Lmol•L-1的NaC1O溶液中含有C1O-的数目为NA | |
| D. | 1molNa被完成氧化生成Na2O2,失去个2NA电子 |
查看答案和解析>>
科目: 来源: 题型:推断题
| 阳离子 | Na+ Mg2+ Al3+ Ba2+ Fe3+ |
| 阴离子 | OH- Cl- CO32- SO42- HCO3- |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验编号 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1H2C2O4溶液 | 水 | 1mol•L-1MnSO4溶液 | 反应温度/℃ | 反应时间 |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 125 |
| Ⅱ | V1 mL | V2 mL | 1mL | 0 | 20 | 320 |
| Ⅲ | V3 mL | V4 mL | V5mL | 0 | 50 | 30 |
| Ⅳ | 2mL | 2mL | 0 | 2滴 | 20 | 10 |
查看答案和解析>>
科目: 来源: 题型:解答题
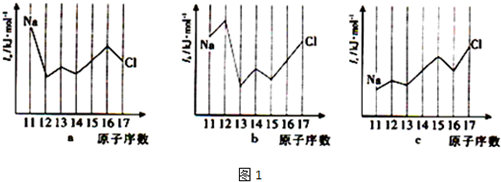
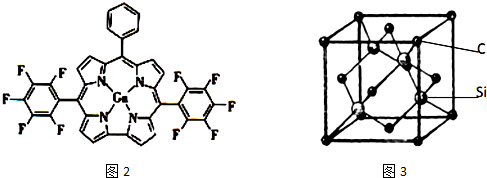
查看答案和解析>>
科目: 来源: 题型:推断题
| 阳离子 | K+ Na+ Cu2+Al3+ |
| 阴离子 | SO42-HCO3-NO3- OH- |
查看答案和解析>>
科目: 来源: 题型:解答题
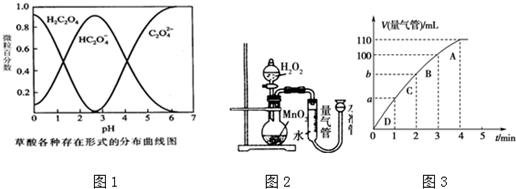
| 实验编号 | T/K | 催化剂的用量/g | 酸性KMnO4溶液的浓度/mol•L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.010 | a.实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和③探究温度对反应速率的影响; c.实验①和④探究催化剂对反应速率的影响. |
| ② | ||||
| ③ | 0.010 | |||
| ④ |
| 实验编号 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| Ⅰ | 14.0 | 13.0 | 11.0 |
| Ⅱ | 6.5 | 6.7 | 6.8 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
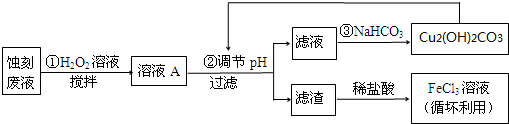
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 最高价氧化物水化物的碱性:Y<Z | B. | 简单气态氢化物的热稳定性:X<W | ||
| C. | 简单气态氢化物的沸点:X<W | D. | 简单离子的还原性:X<W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com