
科目: 来源: 题型:选择题
| A. | NaBiO3 | B. | Na4XeO6 | C. | K2S2O8 | D. | PbO2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铝片与盐酸反应生成氢气 | B. | 氢氧化铝溶于强碱溶液 | ||
| C. | 氢氧化铝溶于强酸溶液 | D. | 铝热反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 5.1 g | B. | 10.2 g | C. | 13.6 g | D. | 15.3 g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1:3 | B. | 2:3 | C. | 1:4 | D. | 2:1 |
查看答案和解析>>
科目: 来源: 题型:实验题
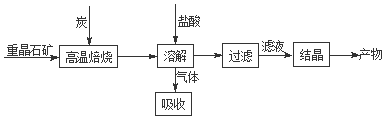
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 120℃,将wg甲醛在足量空气中燃烧,将生成产物用固体Na2O2(过量)吸收,固体增重wg | |
| B. | 24gMg带在足量CO2气体中燃烧,生成固体质量为40g | |
| C. | 相同物质的量的Al、Al2O3、Al(OH)3与足量NaOH溶液反应,溶液增重相等 | |
| D. | 在Fe3O4与足量浓硝酸的反应中,参加反应的Fe3O4与体现酸性的HNO3物质的量之比为1:10 |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:解答题
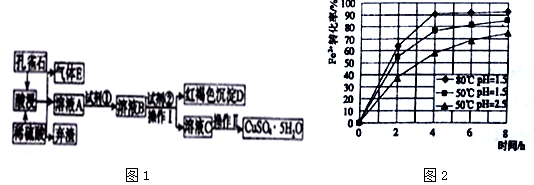
| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe(OH)3 | 2.2 | 3.2 |
| Fe(OH)2 | 7.6 | 9.6 |
| Cu(OH)2 | 4.7 | 6.4 |
查看答案和解析>>
科目: 来源: 题型:实验题
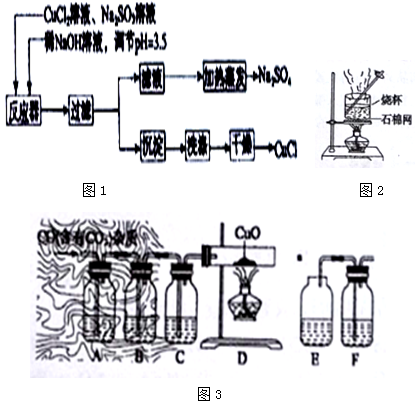
查看答案和解析>>
科目: 来源: 题型:解答题
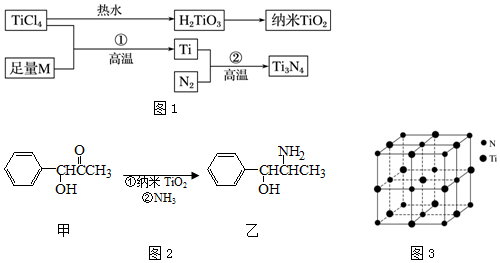
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1451 | 7733 | 10540 | 13630 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com