
科目: 来源: 题型:选择题
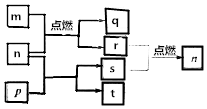 短周期主族元素X、Y、Z、W原子序数依次增大,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种耐高温材料,它们的关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W原子序数依次增大,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种耐高温材料,它们的关系如图所示.下列说法正确的是( )| A. | Y、Z、W的简单离子的电子层结构相同 | |
| B. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| C. | 简单氢化物的稳定性:X>Y | |
| D. | Y与Z两种元素形成的化合物一定只含离子键 |
查看答案和解析>>
科目: 来源: 题型:推断题
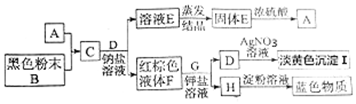
 .该反应中的氧化剂是二氧化锰.
.该反应中的氧化剂是二氧化锰.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.15NA | B. | 0.6NA | C. | 1.2NA | D. | 2.4NA |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 18g D2O和18g H2O中含有的质子数均为10NA | |
| B. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 | |
| C. | 第IA族元素铯的两种同位素137Cs比133Cs多4个质子 | |
| D. | 中子数为146、质子数为92的铀(U)原子:${\;}_{92}^{146}$U |
查看答案和解析>>
科目: 来源: 题型:实验题
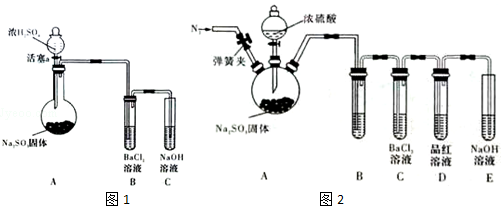
查看答案和解析>>
科目: 来源: 题型:多选题

| A. | 滤液A中阳离子为Fe2+、H+ | B. | 样品中金属Fe的质量为2.14g | ||
| C. | 样品中CuO的质量为4.0g | D. | V=448 |
查看答案和解析>>
科目: 来源: 题型:实验题
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| 盐酸液的体积(mL) | 30 | 30 | 30 | 30 |
| 样品(g) | 3.32 | 4.15 | 5.81 | 7.47 |
| 二氧化碳的体积(mL) | 672 | 840 | 896 | 672 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com